作者:企鹅
近日,ACS Nano杂志(影响因子13.903)发表了一篇题为“Mapping Subpopulations of Cancer Cell-Derived Extracellular Vesicles and Particles by Nano-Flow Cytometry”细胞外膜泡/颗粒亚群分析的文章,利用纳米流式细胞仪和高分辨率显微镜技术对不同细胞外膜泡/颗粒进行了表征分析。
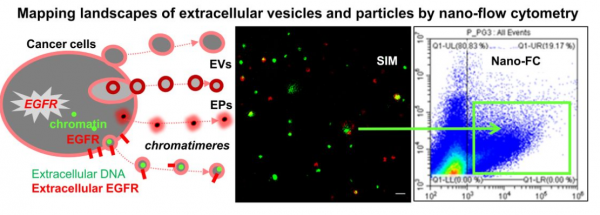
恶性转化、微环境的改变以及治疗应激都影响着癌细胞的分泌组。细胞外颗粒(extracellular particles, EP)和膜囊泡(membranous vesicles, EV)从肿瘤细胞中主动释放,可反映其特性和状态。EV/EP也成为细胞内部和外部分子之间的中心调节剂,可作为细胞间信息传递的途径。在EV中,分子成分(蛋白质、核酸)被脂质双层包裹,其膜上的蛋白参与与囊泡生物发生有关的各种过程。这些过程包括细胞质膜的直接出芽,形成可变但通常更大的EV(直径> 150 nm),通常称为微泡(MVs),或ectosomes。包裹在多泡内体(MVB)内的小管腔内囊泡(<150nm; ILV)的胞吐作用产生被称之为外泌体的EV。非膜性EP,例如exomeres(我们暂译为“外泌颗粒”),也可能从癌细胞中释放,但其功能和成分的了解较少,其他无特征的EP/EV亚型的性质也是如此。通常很难确定我们正在研究的纳米颗粒或它们的天然混合物是膜状的还是固体的,因此我们将它们描述为颗粒或EV/EP,除非它们的性质是特别定义的。
虽然当前EPs/EVs的批量纯化和分析方法能够鉴定(但非排他地)与特定的上述颗粒亚型相关联的分子特征,但是越来越发现颗粒分泌组内具有很大的异质性。例如,蛋白质组学分析显示,即使从单一细胞来源纯化的小型EV的分离物中存在超过1,000种蛋白质信号。这些数字意味着存在多个未被揭示的EV/EP子集,因为这样的蛋白质负载会超过单个小型EV/EP的物理容量。由于EV低于大多数标准光学成像方法的分辨率阈值,它们各自的分子特征和多样性长期以来都限制了更全面的评估,从而模糊了EV的真正复杂性和EP不同亚群的情况。如同了解颗粒分泌组的动态结构的重要性,这些都反映并影响了癌症的生物学和治疗反应。事实上,越来越多的证据表明,EVs及其生物活性和致癌物质可能会影响多种癌症相关过程,如细胞生长、血管生成、免疫反应和转移。虽然已经研究了这些过程的一些分子效应物,但是仍然不清楚对癌症进展和微环境的影响是否归因于特定的EV亚群,或者是组合性质。
该研究描述了纳米流式细胞仪和高分辨率显微镜技术的互补使用,作为重建EV/EP群体的结构及其在恶性转化和靶向治疗诱导的应激条件下的变化的工具。该方法不仅能够实现颗粒的全貌高通量免疫表型分析,还能够通过传统的制备批量分析方法提供对其内部结构和不可获得的差异生物学特性的见解。
具体来说,该研究采用优化的多色纳米流式细胞仪、结构照明显微镜(SIM)和原子力显微镜(AFM)来桥接单个EV/EP水平的敏感检测和癌细胞分泌蛋白的高通量分析。研究将这些方法应用于由几种不同转化机制驱动的完整细胞释放的颗粒,或应用于其致癌驱动因子[例如表皮生长因子受体(EGFR)]的药理学抑制所施加的治疗应激下的细胞。报道展示了EV/EP货物的生物相关元素的高度异质分布,包括癌蛋白(EGFR)、凝血因子(组织因子)、转移前整合素(ITGA6、ITGA4)、四跨膜蛋白(CD63)和整个基因组DNA。癌细胞的微粒分泌蛋白。研究观察到用不可逆激酶抑制剂(达克替尼)靶向EGFR活性会触发通过EP/EV亚群的DNA的释放,包括含有EGFR和DNase抗性染色质的颗粒(chromatimeres)。纳米流式细胞仪能够在整个特定分泌蛋白组中量化这些变化;SIM揭示了EV/EP子集的单个分子形貌;AFM揭示了它们的一些物理性质,包括纳米丝和其他子结构的存在。此外,该报道描述了不同EV子集的差异摄取率,导致癌细胞对外泌体样小EV的优先内化,排除了较大的EV。因此,该研究说明纳米流式细胞仪结合高分辨率显微镜用于更精确地研究癌症相关EV/EP的潜力。
该研究使用配备有3个激光(405、488和640 nm波长)的CytoFLEX系统(Beckman Coulter, Pasadena, CA)进行纳米流式细胞术。
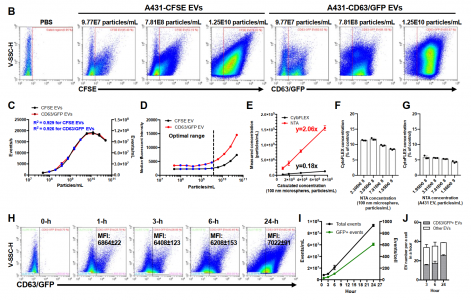
A431 EVs的纳米流式分析
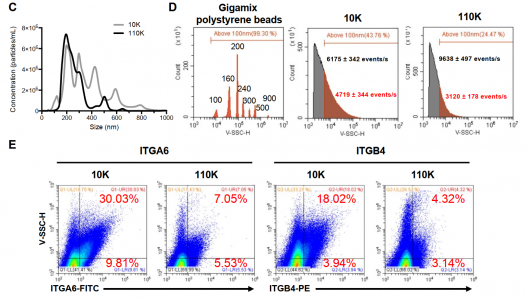
纳米流式细胞仪可区分以不同超速离心速度沉淀的EV级分
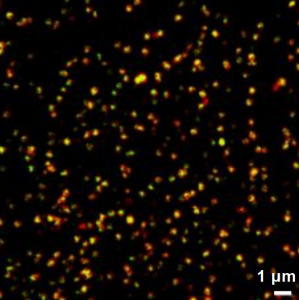
使用抗CD63抗体和遗传CD63-GFP标签的双重标记的单个A431颗粒(主要是EV)的结构照明显微镜(SIM)图像揭示了这些技术的一致性和单个EV的结构复杂性。
实际上,通过使用纳米流式细胞仪来提高各种EV/EP亚群的分辨率提出了关于其生物学功能是否也存在类似多样性的问题。在这方面,该研究指出,与同一制剂中较大的MV相比,小外泌体样EV的细胞摄取显著不同。鉴于其与EV细胞相互作用有关的整合素的较高表达水平,较大的EV摄取较差是令人惊讶的。EV摄取受多种机制控制,包括膜融合、胞吞作用和巨胞饮作用。了解这些或其他过程如何解释上述差异具有相当大的意义。差异EV/EP内化过程被认为受受体细胞调节,如致癌转化、表面特性和吞噬表型。当然,EVs/EPs本身的特性也起作用。后者要求我们更好地掌握EV/EP亚群的内在复杂性,正如该研究文献所述,纳米流式细胞仪与高分辨率显微镜相结合可能提供有吸引力的解决方案。
总之,纳米流式细胞仪结合高分辨率显微镜可以深入了解癌细胞分泌组的分子、结构和功能多样性。
参考文献:
Choi D, Montermini L, Jeong H, Sharma S, Meehan B, Rak J. Mapping Subpopulations of Cancer Cell-Derived Extracellular Vesicles and Particles by Nano-Flow Cytometry. ACS Nano. 2019 Aug 30. doi: 10.1021/acsnano.9b04480. [Epub ahead of print]