土豆
外泌体是参与细胞间通讯和肿瘤微环境调节的重要元件,但是肿瘤外泌体促进免疫抑制微环境产生的确切机制仍不清楚。来自山东大学齐鲁医院、脑与类脑科学研究院李刚、薛皓课题组的研究人员研究了胶质瘤衍生的外泌体(GDEs)对巨噬细胞极化和胶质瘤进展的影响,发现胶质瘤在缺氧环境下传递miR-1246靶向TERF2IP进而影响STAT3和NF-κB途径,最终诱导巨噬细胞M2极化。该研究发表于Oncogene杂志上(影响因子6.634)。
神经胶质瘤(Glioma)是中枢神经系统中最常见和最致命的原发性肿瘤,占恶性脑肿瘤的80%。尽管目前对胶质瘤的认识在增加,外科技术、放疗和化疗的技术在突破,但胶质瘤(特别是胶质母细胞瘤GBM,WHO IV级胶质瘤)患者的预后仍然很差,中位生存时间小于15个月。恶性胶质瘤对治疗的耐受是由于其具有独特的免疫抑制性肿瘤微环境,微环境涵盖了肿瘤细胞、成纤维细胞、各种免疫细胞以及各种环境因素等。
缺氧是神经胶质瘤微环境的特征。巨噬细胞是一种位于神经胶质瘤微环境中和周围的原代免疫细胞,优先积聚在缺氧区域,在那里极化为特定的细胞类型。巨噬细胞有两种极化的细胞表型,包括经典激活的巨噬细胞(M1型)和活化的巨噬细胞(M2型)。IL6、TNF-α和IL-12是抑制肿瘤进展的M1型巨噬细胞的标志物。CD163、CD206、IL-10和TGF-β是可以促进肿瘤进展的M2型巨噬细胞的标志物。作为胶质瘤微环境中最丰富的免疫细胞,肿瘤相关巨噬细胞(TAMs)可以通过与肿瘤细胞的相互作用而重编程,可能会转变为免疫抑制性肿瘤微环境中的M2型巨噬细胞。此外,缺氧微环境也可以促进TAM的M2极化。
外泌体是由大多数细胞分泌的小膜囊泡(大小为30-100 nm)。包含mRNA、microRNA、长链非编码RNA和蛋白质的外泌体通过将其内容物递送至受体细胞而在细胞间通讯中发挥重要作用。肿瘤外泌体可通过传递遗传物质来抑制免疫细胞的功能。研究表明,缺氧可以改变外泌体的释放和内容物,并通过调节细胞间通讯来影响受体细胞功能。该研究团队此前证明,缺氧可以影响胶质瘤衍生的外泌体(GDEs)的含量,并进一步增加骨髓来源的抑制细胞(MDSCs)的扩增和免疫抑制功能。缺氧是否也影响胶质瘤衍生的外泌体的遗传物质,诱导TAM的极化并调节它们的功能之前并不清楚。
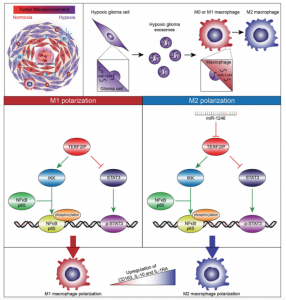
在本研究中,研究人员首先分离了胶质瘤细胞衍生的外泌体(GDE),并确认GDE可以被巨噬细胞内化。对GDE进行了microRNA测序分析,鉴定了介导巨噬细胞极化的microRNA。研究人员进一步研究了巨噬细胞中与microRNA相关的细胞内信号传导途径。结果发现,与常氧胶质瘤衍生的外泌体(N-GDEs)相比,缺氧胶质瘤衍生的外泌体(H-GDEs)显著诱导M2巨噬细胞极化,从而在体外和体内促进胶质瘤增殖、迁移和侵袭。MicroRNA测序分析显示miR-1246是H-GDEs中富集度最高的microRNA。此外,miR-1246在胶质瘤患者的脑脊液(CSF)中富集并且在肿瘤切除后减少。通过靶向TERF2IP激活STAT3信号通路并抑制NF-κB信号通路,确定miR-1246介导H-GDE诱导的M2巨噬细胞极化。
该研究阐明了缺氧胶质瘤通过外泌体影响M2巨噬细胞极化的机制,促进免疫抑制微环境的形成。此外,这些结果表明胶质瘤患者脑脊液中的miR-1246可能是胶质瘤诊断的新型生物标志物,靶向mRNA-1246的治疗可能有助于抗肿瘤免疫治疗。
参考文献:Qian M, Wang S, Guo X, Wang J, Zhang Z, Qiu W, Gao X, Chen Z, Xu J, Zhao R, Xue H, Li G. Hypoxic glioma-derived exosomes deliver microRNA-1246 to induce M2 macrophage polarization by targeting TERF2IP via the STAT3 and NF-κB pathways. Oncogene. 2019 Sep 4.doi: 10.1038/s41388-019-0996-y.