文末有《流式细胞术实验手册》书籍赠送!
体液中的细胞外囊泡(EV)是具有双层膜结构的异质混合物,具有广泛的大小、分子组成和细胞来源。值得注意的是,即使是来自同一细胞类型的囊泡也可能表现出明显的多样性,主要是在核酸(DNA和RNA)方面。miRNA代表了在囊泡中发现的主要RNA类型之一,而带有miRNA的EV参与细胞间的通信,调节靶细胞内部的基因表达。另外,已有研究显示miRNAs可能在各种组织和细胞类型中改变。然而,尽管人们很想检测囊泡亚群中的miRNA谱,但仍难以实现这一目标。
由于分子内容和功能的异质性,对EV进行更全面的分析需要分离其各个亚群。为此,已有很多研究报道了各种分离EV的方法。一些方法,例如差速离心和凝胶过滤可根据物理性质(大小、密度等)分离颗粒,一些方法则根据其生物分子组成。可以通过基于抗体的方法分离特定的囊泡群体。然而,需要注意的是,这种方法有许多缺点。特别是,它们既不能分离带有两个或多个表面蛋白标记的囊泡,也不能确定颗粒的大小范围。可以使用磁珠通过顺序免疫捕获进行分离,但也有局限性。也不能使用不同表达水平的标记来分离囊泡。基于高灵敏度流式细胞仪的方法,使用针对囊泡表面标记的荧光标记抗体被认为是最有前途的方法,可用于对EVs亚群进行分选,随后对其分子成分进行分析。
高灵敏度的流式细胞仪(hs-FCM)能够检测100‒200 nm的聚苯乙烯珠,甚至40‒80 nm的Au和Ag颗粒。此外,以前的范德波尔(Van der Pol)指出,hs-FCM的最小可检测囊泡大小可能小至150-190 nm,为深入分析EV的异质性提供了新的可能性。多色分析、正门控和负门控以及荧光强度的评估使实验人员能够大大扩展可分离囊泡亚群的数量。最近,已有研究通过基于类似hs-FCM方法的光学处理,应用高灵敏度荧光激活囊泡分选(hs-FAVS)方法来尝试纯化EV亚群。特别是,它用于分离凋亡小体,以及在其表面带有СD9和表皮生长因子受体亚型的小泡。类似地,使用荧光标记的抗CD9和抗CD63抗体将分类技术应用于骨髓肥大细胞释放的囊泡。此外,对从脑脊液、眼泪或机械破坏的MDCK细胞获得的细胞内囊泡进行了分类,以进行蛋白质组学分析。然而,以前从未研究过通过hs-FAVS获得的囊泡亚群的核酸库。
很少有研究对血浆细胞外小泡进行分选。然而,由于存在大量其他掩盖EV的纳米颗粒,例如脂蛋白、乳糜微粒和抗体复合物,从这种多组分体液中分离EV仍然是一项艰巨的任务。此外,在血浆中发现了由多种细胞类型分泌的囊泡,它们的数量相差很大。特别是,已证明80%的血浆EV来自血小板,尽管红细胞是血液中的主要细胞类型。
靶向分离EV的方法的开发具有特别重要的意义,因为它将为研究EV亚群特异性核酸库及其在调节病理和生理过程中的意义提供一个机会。
该研究的目的是为了探究使用高灵敏度荧光激活囊泡分选方法分离的不同的血浆细胞外囊泡亚群的细胞来源依赖性核酸库。
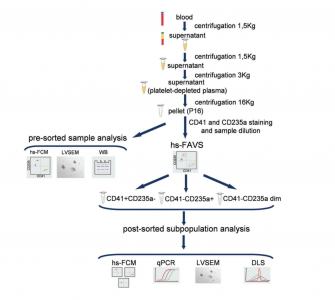
研究方案流程
高灵敏度荧光激活囊泡分选
使用配备200 mW 488 nm、55 mW 405 nm和100 mW 645 nm激光的MoFlo Astrios EQ细胞分选仪(Beckman Coulter)进行高灵敏度荧光激活囊泡分选(hs-FAVS),同时也配备了针对每种激光类型优化的标准滤光片组。使用70 μm空气喷射喷嘴(Jet-in-air)进行设置和进一步分选,IsoFlow鞘液的压力为59.7‒60 psi,样品流的压力为60.9‒61.1 psi,以每秒3,000-8,000个事件的速度,不会造成聚集或重合。
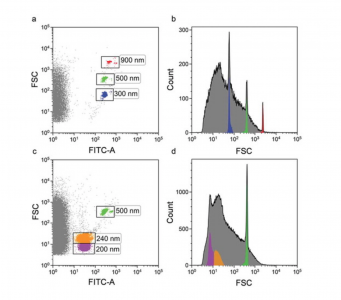
来自488 nm激光器的前向散射用作触发信号以区分噪声。Megamix-Plus FSC(100、300、500和900 nm)和Megamix-Plus SSC(160、200、240和500 nm)用于初步设置。设置FSC和FITC荧光通道增益,以使微球可见。两种试剂盒中最小的微球(100 nm和160 nm)无法观察到。测量FSC1和FSC2参数的双光放大器光学电子处理系统可检测到200 nm小的聚苯乙烯珠。
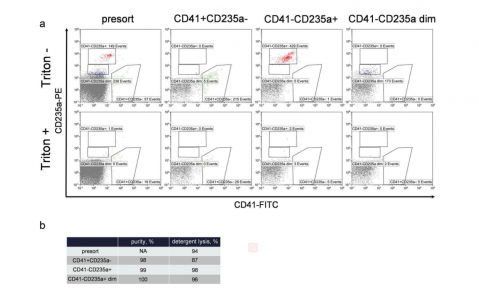
来自九名健康志愿者的血浆用于分析。通过血浆离心分离获得EV样品。通过使用荧光基团偶联的anti-CD41-FITC和anti-CD235a-PE抗体进行高灵敏度荧光激活囊泡分选(hs-FAVS),可以分离出EV的三个亚群,即CD41+ CD235a-、CD41-CD235a+和CD41-CD235a弱阳性。通过高灵敏度流式细胞仪验证了分选亚群的高纯度(>97%)。低压扫描电子显微镜和动态光散射相结合,确认了样品中存在纳米尺寸的颗粒。
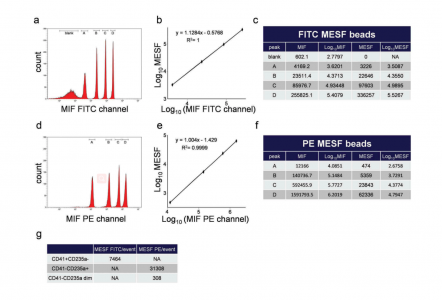
使用Cytoflex S流式细胞仪产生的CD41+ CD235a-、CD41-CD235a+和CD41-CD235a弱阳性亚群的等量可溶性荧光分子数(MESF)的计算
分选样品的量足以执行基于定量聚合酶链反应(qPCR)的核酸定量。在CD41+ CD235a-与CD41-CD235a+囊泡之间发现了最显著的核酸差异:前者的线粒体DNA含量高得多(p = 0.004),血小板富含的miR-21-5p(4倍)、miR-223-3p(38倍)和miR-199a-3p(187倍),但红细胞富含的miR-451a含量较低(90倍)。CD41-CD235a+和CD41-CD235a弱阳性的miR-451a(p = 0.016)和miR-21-5p(p = 0.031)的水平有所不同。在所有EV亚群中,核DNA均低于检测极限。基于hs-FCM确定的分选EV的数量可以计算每个单事件(每个EV)miRNA浓度。
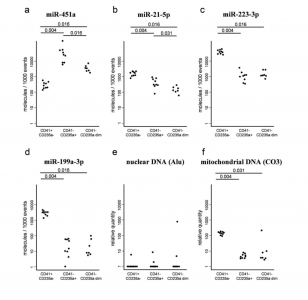
结果表明,CD41+ CD235a-亚群中最丰富的是miR-223-3p,每个事件达到38.2个分子。在CD41-CD235a+亚群中,最丰富的是miR-451a,每个事件达到24.7个分子。
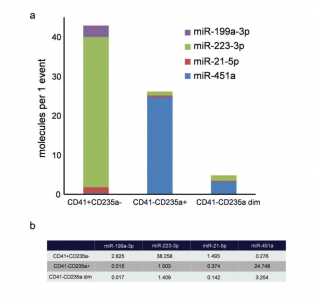
分选的EV亚群中miRNA水平的比较
综上所述,该研究发现表明,源自红细胞和血小板的EV具有不同的核酸库,这与其来源细胞的组成相似。该研究证明hs-FAVS是分析EV不同亚群的有用方法,因为它有助于量化和准确分离EV特定亚群,其数量可以进行后续核酸谱分析。hs-FAVS的应用使得揭示来自血浆的红细胞和血小板衍生的EV携带不同的DNA和microRNA库成为可能。
结论:
- hs-FAVS的应用可以分离出高纯度的不同EV亚群。
- 分选的EV数量足以分离RNA/DNA并进行基于qPCR的核酸定量。
- 基于hs-FAVS确定的分选EV的数量可以计算每单个事件miRNA浓度。
- 红细胞和血小板衍生的EV携带不同的核酸库。
参考文献:
Kondratov K, Nikitin Y, Fedorov A, Kostareva A, Mikhailovskii V, Isakov D, Ivanov A, Golovkin A. Heterogeneity of the nucleic acid repertoire of plasma extracellular vesicles demonstrated using high-sensitivity fluorescence-activated sorting. J Extracell Vesicles. 2020 Mar 30;9(1):1743139. doi: 10.1080/20013078.2020.1743139. eCollection 2020.
相关阅读:
https://mp.weixin.qq.com/s/b4AMyD6IvcDW_a14um82xg
https://mp.weixin.qq.com/s/1_KmWFj-X819PCdHSBhGww
https://mp.weixin.qq.com/s/ScEqg_bt1hIos8hdzfBN1w
点击左下角阅读原文或长按下图扫二维码填写表单,赠送一本《流式细胞术实验手册》,共30本,先到先得!
阅读原文链接:https://www.wjx.top/jq/78410162.aspx
外泌体资讯网 JEV:高灵敏度荧光激活分选证实血浆EV核酸库的异质性