作者:企鹅
胰腺癌在所有癌症中的死亡率最高,5年生存率仅为8%。在大约15%的新诊断病例中,肿瘤是非转移性和可切除的,大多数患者最终会在手术后两年内发生局部或远处肿瘤复发,这通常与恶病质的快速发展有关。恶病质是一种消瘦综合征,其特征在于进行性体重减轻、肌肉损失、疲劳、虚弱和食欲显著丧失。超过80%的胰腺癌患者患有恶病质综合征。此外,患有严重恶病质综合征的癌症患者对化学疗法和放射疗法反应差,并且这些疗法的结果更差。总体而言,恶病质的潜在生物学机制知之甚少,以前的数据表明,肌肉萎缩可能是由肿瘤衍生的信号因子引起肌肉降解引起的。调控这种现象的分子机制仍不清楚。
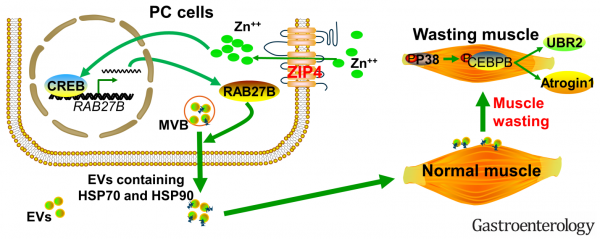
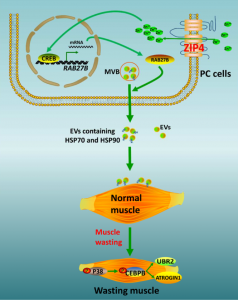
美国俄克拉荷马大学的研究人员最近发现了一种锌转运蛋白ZIP4,它是胰腺肿瘤生长和转移的调节因子。ZIP4表达与胰腺癌小鼠模型中的肿瘤进展和存活相关,表明ZIP4可以调节肿瘤功能。该研究显示ZIP4还通过促进细胞外囊泡(EV)释放HSP70和HSP90刺激肌肉萎缩,在胰腺癌相关恶病质中发挥重要作用。EV相关的HSP70和HSP90,作为激活TLR4的危险相关分子模式(DAMP),刺激p38MAPK介导的肌肉分解代谢。通过使用2D细胞培养物、3D球体/类器官和治疗性小鼠胰腺癌模型,该报道明确了ZIP4在促进胰腺癌相关恶病质方面先前未发现的作用。ZIP4敲低降低了体重和肌肉质量的损失,并提高了生存率。此外,降低该锌转运蛋白的水平可通过抑制肿瘤EV释放HAP70和HSP90来抑制肌肉萎缩,该过程是通过抑制CREB调节的RAB27B(EV释放所需的GTP酶)的表达来实现的。这些数据揭示了胰腺癌中恶病质和肌肉萎缩的先前未鉴定的分子机制,并且在此过程中定义了锌信号传导的新作用。
方法:
利用人胰腺癌细胞系(AsPC-1和BxPC-3)生长的原位肿瘤的裸鼠;在细胞注射后8天取出肿瘤并进行组织学分析。通过Kaplan-Meier曲线分析小鼠存活。在AsPC-1和BxPC-3细胞中敲低ZIP4;空载的细胞用作对照。从小鼠收集肌肉组织并进行组织学和免疫组织化学分析。将来自细胞系的条件培养基和癌细胞的三维球体/类器官培养物处理C2C12肌管。通过免疫印迹、ELISA和免疫荧光分析肌管和培养基。从条件培养基中分离EV并进行免疫印迹分析。
主要发现:
- ZIP4敲低可提高远端胰腺切除术后的生存率;
- ZIP4敲低和手术切除的组合改善了小鼠的肌肉萎缩和恶病质;
- ZIP4通过增强p38MAPK介导的肌肉分解代谢促进胰腺癌诱导的肌肉萎缩;
- ZIP4通过增加胰腺癌细胞的EV相关HSP70和HSP90的RAB27B依赖性释放来促进p38MAPK介导的肌肉分解代谢。
ZIP4→CREB→RAB27B→(EV-HSP70-HSP90)→p38MAPK→CEBPB→Muscle wasting
参考文献:
Yang J, Zhang Z, Zhang Y, Ni X, Zhang G, Cui X, Liu M, Xu C, Zhang Q, Zhu H, Yan J, Zhu VF, Luo Y, Hagan JP, Li Z, Fang J, Jatoi A, Fernandez-Zapico ME, Zheng L, Edil BH, Bronze MS, Houchen CW, Li YP, Li M. ZIP4 Promotes Muscle Wasting and Cachexia in Mice with Orthotopic Pancreatic Tumors by Stimulating RAB27B-Regulated Release of Extracellular Vesicles From Cancer Cells. Gastroenterology. 2018 Oct 17. pii: S0016-5085(18)35157-6. doi: 10.1053/j.gastro.2018.10.026. [Epub ahead of print] PMID: 30342032
外泌体资讯网 ZIP4调节癌细胞胞外囊泡的释放,促进原位胰腺肿瘤小鼠的肌肉萎缩和恶病质 | Gastroenterology