土豆
研究表明,缺氧诱导的15-LO2/15-HETE在肺动脉高压(PH)中起重要作用。细胞中15-LO2 / 15-HETE的转运机制并不清楚。近日,来自哈尔滨医科大学的研究人员在Cell Death & Disease杂志发表研究成果,揭示了外泌体和货物15-LO2在肺血管稳态中对肺动脉高压的发病机制的影响。
肺动脉高压(Pulmonary artery hypertension,PH)是一种威胁生命的疾病,其特征在于肺血管重塑的病理表现,导致右心室后负荷加重,右心衰竭,并最终导致死亡。细胞增殖的增加和血管壁内膜活性增加是导致肺血管重塑的主要细胞行为。然而,肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)在肺血管稳态中的功能障碍和PH的进展所涉及的潜在机制仍不清楚。
外泌体是膜包被的细胞外囊泡,直径30-150nm,通过胞吐途径产生,并包含有一系列功能性生物分子(脂质、蛋白质、mRNA和miRNA),在确定的微环境中局部发挥功能(旁分泌或自分泌作用),或进入体循环以作用于远端部位(内分泌作用)。据报道,肿瘤干细胞分泌的外泌体以内分泌方式与正常细胞相联系,抑制肿瘤免疫反应,并对肿瘤转移产生极大的影响。证据表明,来自间充质基质细胞的外泌体以旁分泌方式抑制PH中的炎症反应。然而,尚不清楚外泌体作为一种细胞外囊泡是否以旁分泌或自分泌方式影响肺血管稳态中PAEC的功能障碍,以及外泌体的细胞起源、PAEC衍生的外泌体在PH过程中的作用。
脂质过氧化酶15-脂氧合酶2(The lipid-peroxidizing enzyme 15-lipoxygenase2,15-LO2),可以优先将花生四烯酸代谢为15-羟基二十碳四烯酸(15-HETE),广泛分布于肺血管中。研究团队以前的研究表明,缺氧条件下PAECs和肺动脉平滑肌细胞中15-LO2大量表达,15-LO2的上调随后对细胞增殖、抗凋亡活性和血管收缩生理环境产生影响,最终导致PH产生。鉴于缺氧条件下PAEC细胞质中15-LO2的分布,研究人员提出细胞质中15-LO2与外泌体之间的相互作用可能调节PH中的肺动脉重塑。
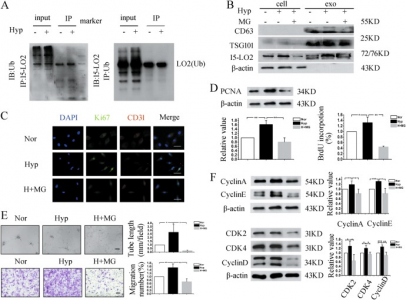
在这项研究里,研究人员研究了含有15-LO2的外泌体在缺氧诱导的肺动脉内皮细胞(PAECs)过度增殖中的特异性参与情况及其潜在机制,发现缺氧增加外泌体的分泌,并以旁分泌或自分泌方式对受体PAEC作用并发挥其促增殖功能。这部分归因于外泌体中15-LO2的富集,然后激活STAT3信号传导途径。在体外,15-LO2在由缺氧PAEC分泌的外泌体中大量表达和富集,其随后激活STAT3信号传导途径,导致PAEC增殖的强烈增加。用外泌体抑制剂GW4869进行的体内治疗保护肺血管稳态免于功能失调和异常重塑。此外,15-LO2在缺氧条件下被泛素化,并且泛素-蛋白酶体系统的进一步抑制显著抑制了PAECs的增殖,表明15-LO2的泛素化可能有助于其分选到外泌体中。这些数据揭示了外泌体货物的作用机制及其随后对PH的影响。
图:15-LO2泛素化可以促进其在缺氧PAEC中向外泌体的包装。
参考文献:Zhang M, Xin W, Ma C, Zhang H, Mao M, Liu Y, Zheng X, Zhang L, Yu X, Li H, Zhu D. Exosomal 15-LO2 mediates hypoxia-induced pulmonary artery hypertension in vivo and in vitro. Cell Death Dis. 2018 Oct 3;9(10):1022.