肾细胞癌(RCC)是常见的泌尿系统恶性肿瘤之一,其中透明细胞肾细胞癌(ccRCC)占所有肾癌病例的70%-80%,侵袭性强且预后较差。由于早期症状隐匿,多数患者确诊时已处于中晚期,传统治疗手段面临巨大挑战。近年来,科学家发现囊泡转运失调与肿瘤发生发展密切相关,但其在肾癌中的调控机制尚不明确,亟需深入探索以开辟新的治疗方向。
2025年6月,天津医科大学医学技术学院岳丹教授团队联合天津医科大学第二医院王勇主任、天津大学陈瑞冰教授,在国际权威期刊Journal of Extracellular Vesicles上发表了题为“Programmed Cell Death Protein 10 (PDCD10) Regulates Vesicle Trafficking and Contributes to the Progression of Clear Cell Renal Cell Carcinoma“的重要研究成果。该研究通过多组学整合分析与功能验证,首次揭示PDCD10通过调控囊泡运输驱动ccRCC恶性进展的分子机制,为肾癌靶向治疗提供了新思路。天津医科大学讲师王蕊、硕士生蔺天宇及天津大学博士生刘羿为论文共同第一作者,岳丹教授、王勇主任、陈瑞冰教授为论文共同通讯作者。该研究受到国家自然科学基金等多个项目支持。
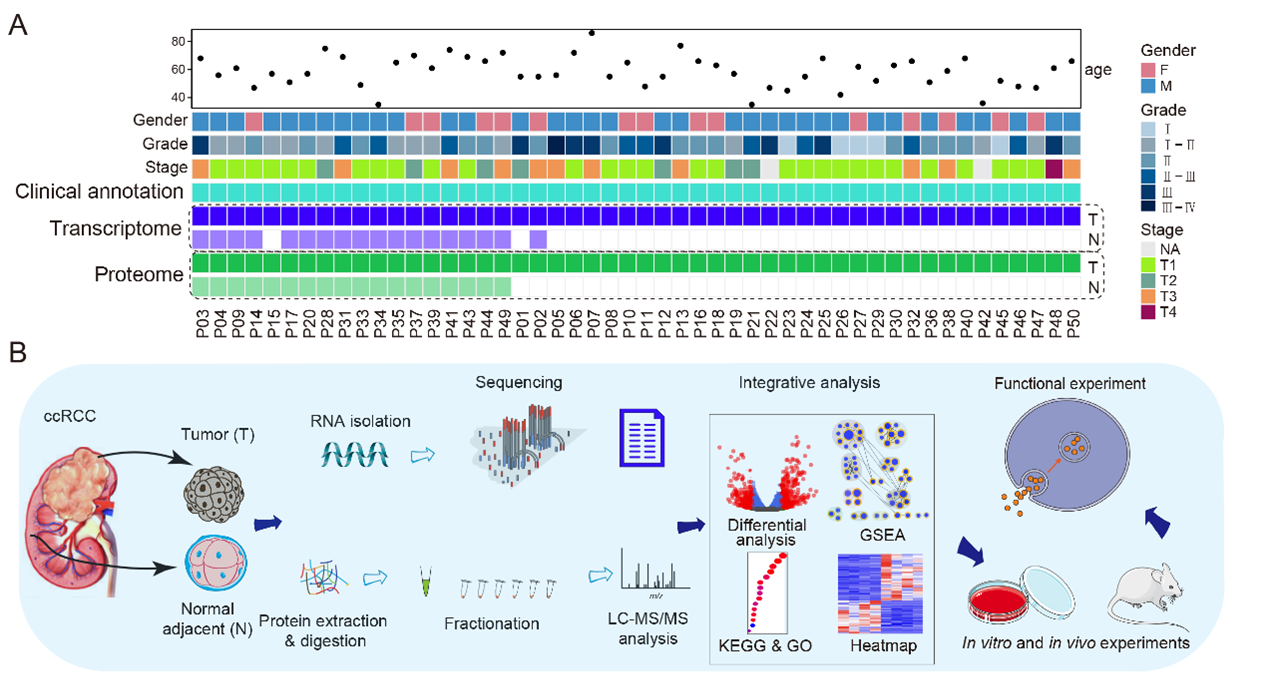
首先,研究团队对50例ccRCC肿瘤/癌旁组织进行转录组和蛋白质组检测,结合生物信息学分析,发现囊泡运输通路在ccRCC中显著紊乱,而PDCD10是这一过程的关键调控因子。值得注意的是,PDCD10此前仅在脑血管疾病(如脑海绵状血管畸形)中被广泛研究,而其在肾癌中的作用尚属首次报道。功能实验表明,PDCD10显著增强肾癌细胞的增殖、迁移、侵袭及黏附能力;动物模型证实,敲除PDCD10可明显抑制肿瘤的生长。
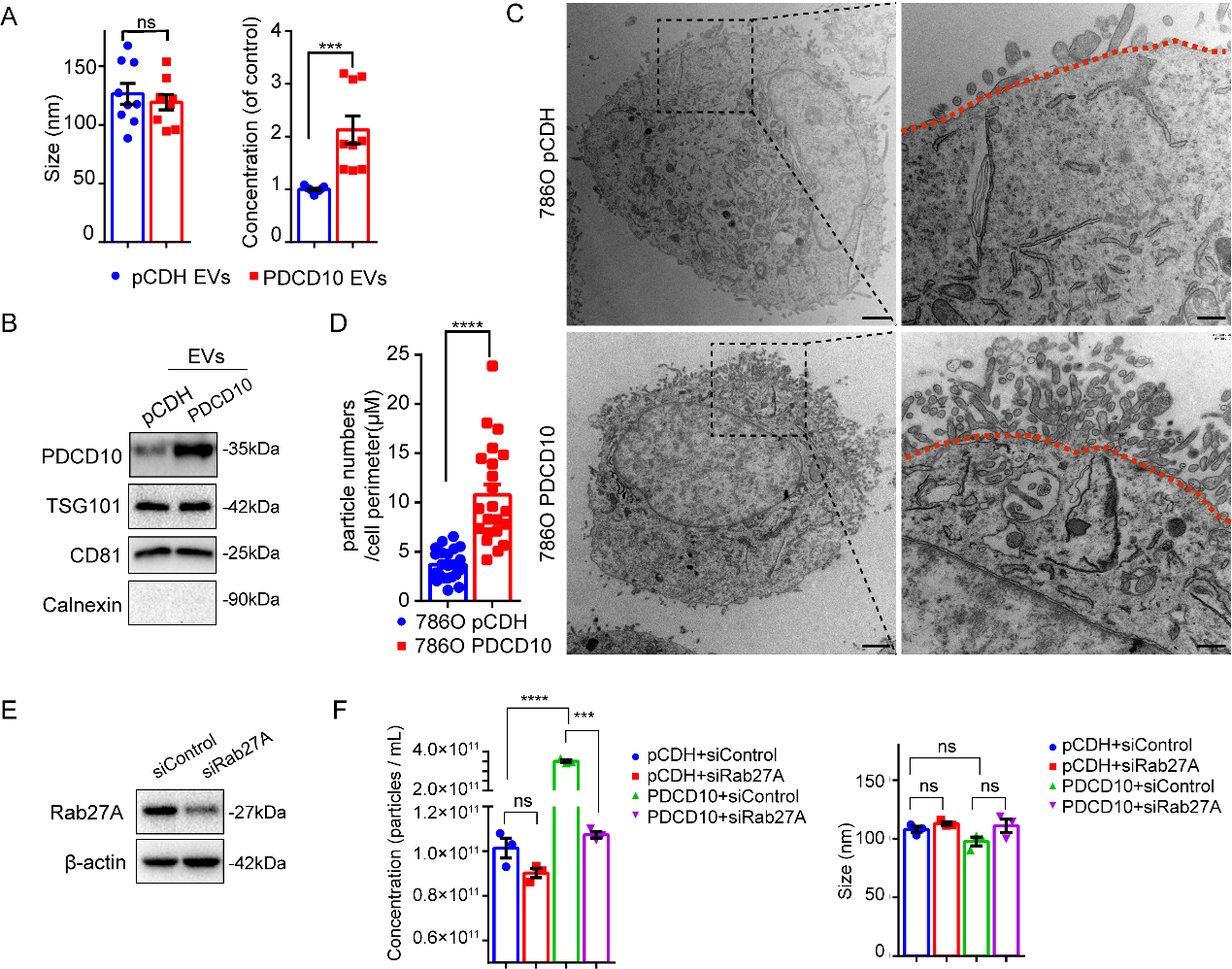
为了揭示PDCD10调控囊泡运输的具体机制,研究团队通过Dextran内吞实验发现,PDCD10过表达的肾癌细胞内吞活性显著增强,表明其促进物质摄取。纳米颗粒追踪分析(NTA)和透射电镜进一步显示,PDCD10过表达导致细胞外囊泡(EVs)分泌量大幅增加。当敲除囊泡分泌关键调控因子Rab27A时,PDCD10的促分泌作用消失,证实其依赖Rab27A通路调控外泌体释放。
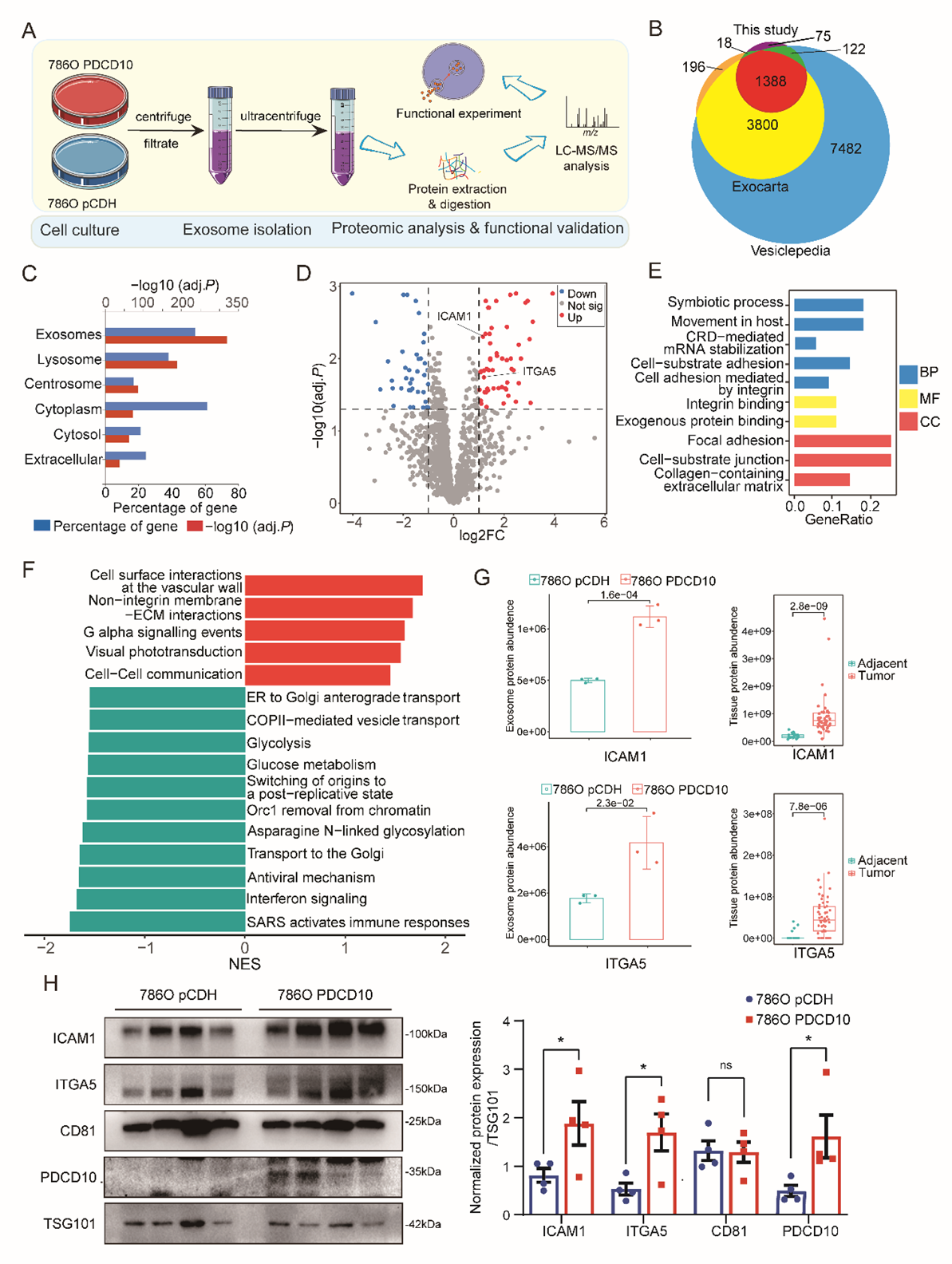
为研究PDCD10是否会影响细胞外囊泡的内容物分选过程,研究团队对PDCD10过表达细胞分泌的细胞外囊泡进行蛋白质组学分析,发现促转移蛋白如细胞间黏附因子1(ICAM1)、整合素 α5(ITGA5)等蛋白丰度显著增高。这些蛋白与肿瘤侵袭、远处转移密切相关,提示PDCD10通过"改造"细胞外囊泡内容物塑造促癌微环境。进一步研究发现PDCD10与内体分选复合物(ESCRT)关键组分CHMP5相互作用,可能通过影响ESCRT复合体功能,精准调控外泌体蛋白分选。细胞实验显示EGFR酪氨酸激酶抑制剂厄洛替尼能够明显抑制由于PDCD10过表达引起的内吞作用的增强及外泌体分泌的增加,同时抑制由于PDCD10升高导致的增迁移及侵袭的增强。
这项研究不仅发现了PDCD10在肾癌中的全新功能,更重要的是揭示了囊泡运输失调如何成为癌症的'隐形推手'。针对PDCD10-囊泡运输途径开发药物,可能为晚期肾癌患者带来突破性疗法。
参考文献:
Programmed Cell Death Protein 10 (PDCD10) Regulates Vesicle Trafficking and Contributes to the Progression of Clear Cell Renal Cell Carcinoma. J Extracell Vesicles. 2025;14(6):e70108. doi:10.1002/jev2.70108
外泌体资讯网 JEV|天津医科大学岳丹教授、王勇主任、天津大学陈瑞冰教授团队发现PDCD10调控囊泡运输并促进肾透明细胞癌进展