每年有多种黄病毒感染全球约五亿人,导致超过12万例死亡和高达90亿美元的经济损失。这些病毒通过蚊子叮咬时的唾液传播。由于这些病毒的蚊媒分布广泛,几乎全球人口都面临登革热病毒(DENV)、寨卡病毒(ZIKV)和西尼罗病毒(WNV)的威胁。感染性的叮咬后,黄病毒被沉积在皮肤中,并最初在成纤维细胞和髓系细胞中繁殖,然后发展为全身感染。皮肤中的病毒增殖是黄病毒的共同特征,也是传播所必需的过程,因此成为迫切需要的泛黄病毒干预措施的潜在靶点。多项证据表明,蚊子唾液中的成分能够增强黄病毒在人类细胞、小鼠模型和非人灵长类动物中的感染能力。尽管一些唾液蛋白可以增强通过叮咬引发的皮肤感染,但生活在流行地区的人群会产生免疫反应,从而削弱这些唾液蛋白的传播增强能力,这提示可能存在其他非免疫性的传播增强因子。目前,对于蚊子唾液中的代谢成分及其在传播中的作用尚无任何数据。
黄病毒是一种包膜的单链正链RNA病毒,其整个增殖周期依赖于宿主细胞的脂质组。多类脂质需要重新配置以适应黄病毒的增殖周期。特别是,鞘脂作为主要结构脂质,在黄病毒感染的人类细胞和登革热患者血清中表现出调节作用。鞘脂具有C18鞘氨醇骨架,并带有极性头基,可与多种分子结合,生成从最简单的神经酰胺到更复杂的糖鞘脂等一系列鞘脂。当与磷酸胆碱基团结合时,神经酰胺生成鞘磷脂(SM)。研究发现,鞘磷脂在成纤维细胞和小鼠中的西尼罗病毒感染中,以及在另一种重要黄病毒——日本脑炎病毒感染的小鼠细胞中,均能促进病毒感染。
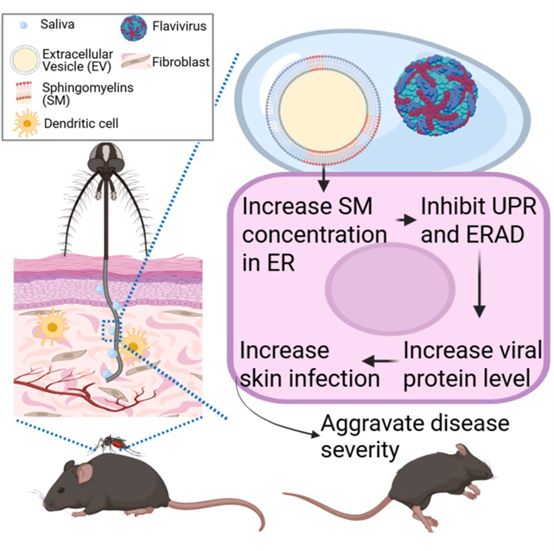
近日发表于Cell Metab杂志的一篇研究利用了近期发现的蚊子唾液中存在的细胞外囊泡,研究唾液脂质在黄病毒传播中的作用。细胞外囊泡是由脂双层膜包裹的球形结构,作为无细胞的细胞间传递载体,能够将货物和膜成分(如脂质)转移到相邻的受体细胞中。研究表明,蚊子唾液中来源于细胞外囊泡的鞘磷脂能够通过重塑人体细胞脂质组,抑制内质网相关的病毒蛋白降解,从而增加皮肤细胞的感染率并促进多种黄病毒的传播。因此,该研究首次发现并阐明了媒介传播疾病中的代谢传播增强因子的作用机制。
蚊子细胞外囊泡脂质增强黄病毒在与传播相关的人类细胞中的感染
为研究蚊子唾液细胞外囊泡(EVs)的影响,研究人员通过超速离心浓缩EVs,并将其补充到感染登革热病毒(DENV)的Huh7细胞中。实验结果显示,补充2或20份浓缩唾液EVs样本均显著增强了感染,而对细胞存活无显著影响。此外,来源于蚊子细胞模型的EVs也被实验验证,补充0.1或1 μL的EV浓缩液显著增加了细胞内DENV基因组RNA(gRNA)拷贝数,同时不影响细胞活性。进一步研究发现,蚊子EVs能够被人类细胞内化,其脂质成分是增强感染的主要因素,而EV蛋白成分对DENV感染无显著作用。
在与黄病毒传播相关的原代皮肤成纤维细胞和单核细胞衍生的树突状细胞(moDCs)中,补充EV脂质提取物同样显著增强了DENV感染,且不影响细胞存活。此外,从蚊子唾液中提取的EV脂质也显示出相同的增强感染效果。这些结果表明,蚊子EVs中的脂质能在多种传播相关细胞类型中增强DENV感染。
进一步分析病毒脂质的作用发现,来源于蚊子细胞的DENV脂质和假感染细胞样本中的脂质均能增强感染,而哺乳动物细胞来源的DENV脂质则无此效果。实验还验证了蚊子EV脂质对其他黄病毒(如西尼罗病毒和寨卡病毒)感染的增强效果,而对一种常见的蚊媒甲病毒(基孔肯雅病毒)的复制无显著影响。
蚊子细胞外囊泡脂质通过抑制病毒蛋白的ER相关降解选择性提升病毒蛋白水平
研究表明,蚊子细胞外囊泡(EVs)中的脂质通过特异性提升黄病毒感染中的病毒蛋白水平来增强感染。尽管EV脂质对病毒的附着和内化无影响,但其能够在感染早期(感染后6小时)显著提高病毒蛋白的翻译水平,而对病毒基因组RNA复制和病毒颗粒组装的影响较晚且间接。
进一步研究发现,EV脂质提升病毒蛋白的机制与内质网相关降解(ERAD)途径的抑制有关。EV脂质并未诱导干扰素通路或影响新生蛋白的整体水平,而是通过降低感染诱导的未折叠蛋白反应(UPR)中的IRE1α信号激活,阻止病毒蛋白的ERAD介导降解。实验显示,EV脂质抑制了UPR相关基因(如Hrd1和Sel1L)的感染诱导表达,而这些基因的沉默也同样提高了病毒蛋白水平。由此表明,ERAD在病毒蛋白降解中起重要作用,而EV脂质通过抑制该途径促进了病毒蛋白的积累。
蚊子唾液细胞外囊泡中的鞘磷脂通过增强细胞内鞘磷脂浓度促进病毒感染
研究发现,蚊子细胞外囊泡(EVs)中的鞘磷脂(SMs)是促进黄病毒感染的关键脂质。通过靶向脂质组学分析,实验检测到至少11种鞘脂类在EV中存在,并利用固相萃取柱将EV脂质分为6个组分。结果显示,仅第6组分(富含95%鞘磷脂)显著增强了登革热病毒(DENV)的感染,而对细胞存活无影响。此外,商用纯化鞘磷脂的补充也增加了病毒感染和病毒蛋白水平,而预处理鞘磷脂溶液和EV脂质组分的鞘磷脂酶(SMase)处理完全阻止了感染增强,进一步验证了SMs的关键作用。
针对真实传播场景的分析表明,单份蚊子唾液中的鞘磷脂含量为1.64至4.07 pmol,与实验中蚊子细胞来源EV的含量(1.19到1.60 pmol)相当。此外,总脂质组学分析揭示,EV脂质通过重新配置宿主细胞脂质组,特别是通过增加ER内的SM浓度,创造了有利于病毒复制的环境。研究发现,EV脂质补充显著上调了与促进病毒感染相关的SM、溶血磷脂和磷脂浓度,同时抑制了部分能量代谢相关脂质(如TAG和DAG)的浓度。此外,SMs浓度的增加主要集中在内质网(ER)区域,那里是IRE1α信号位点。
蚊子细胞外囊泡脂质和鞘磷脂加重小鼠模型中的疾病严重程度
为评估蚊子EV脂质在黄病毒传播中的作用,研究使用对西尼罗病毒(WNV)感染敏感的野生型小鼠模型,模拟蚊子叮咬,通过与WNV同时注射0.1或1 μL的蚊子EV脂质进行实验,覆盖单份唾液中鞘磷脂的含量范围。实验结果显示,与单独感染WNV的小鼠相比,联合注射EV脂质的小鼠体重下降显著加重,症状评分从感染第3天开始恶化,并在第9至11天达到峰值。此外,EV脂质剂量越高,症状越严重,生存率也随之显著下降,0.1和1 μL的EV脂质将生存率从83%分别降低到58%和33%。
为验证鞘磷脂(SMs)的作用,研究进一步在小鼠中与WNV联合注射6.5和32.5 pmol的SMs。结果显示,尽管SMs未改变病毒RNA血症水平,但两种剂量均显著加重了体重下降、症状恶化和生存率降低的疾病指标。
研究发现模式图
研究亮点:
l蚊子唾液细胞外囊泡(EV)脂质增强黄病毒在皮肤细胞中的感染;
l蚊子EV脂质抑制ERAD介导的病毒蛋白降解;
lEV中的鞘磷脂通过增加内质网鞘磷脂水平促进感染;
l 唾液EV中的鞘磷脂增强传播并加重疾病严重程度。
参考文献:
Medkour H, Pruvost L, Miot EF, Gong X, Vaissayre V, Tavadia M, Boutinaud P, Revel J, Hitakarun A, Sornjai W, Zoladek J, Smith DR, Nisole S, Nolte-'t Hoen E, Bertrand-Michel J, Missé D, Marti G, Pompon J. Sphingomyelins in mosquito saliva reconfigure skin lipidome to promote viral protein levels and enhance transmission of flaviviruses. Cell Metab. 2025 Jun 20:S1550-4131(25)00295-5. doi: 10.1016/j.cmet.2025.05.015. PMID: 40543501.





