骨关节炎(Osteoarthritis, OA)是一种常见的老年退行性关节疾病,其特征是关节软骨丧失,软骨下骨发生退行性变化。我国目前罹患膝关节OA的人口也已达1.4亿,是疼痛、残疾和社会经济负担的主要来源。已有研究表明在OA早期软骨下骨早于软骨发生退变,异常的机械力学导致骨-软骨界面血管化、孔隙度、微裂纹和裂缝的增加,软骨下骨释放各种细胞因子到达上覆盖软骨层,加重软骨退变,促进OA进展。骨细胞在软骨下骨中数量最多,对力学刺激极为敏感。然而,关于应力介导的骨细胞-软骨细胞之间的串扰研究尚属空白。因此,研究参与OA发病的分子靶点意义重大,为早期保守干预以减缓或阻断其病理进展提供了临床治疗方向。
近日,南京大学郭保生教授团队在Nature Communications杂志上发表题为“Osteocyte-derived extracellular vesicles mediate the bone-to-cartilage crosstalk and promote osteoarthritis progression”的论文,主要介绍了应力过载介导的软骨下骨骨细胞来源的细胞外囊泡(Extracellular Vesicles, EVs)及其包裹的microRNAs(miRNAs)调控软骨代谢的新机制,并为OA的治疗提供新靶点。南京大学医学院郭保生教授、蒋青教授和蔡平强教授为文章的共同通讯作者;博士研究生刘娜为第一作者。
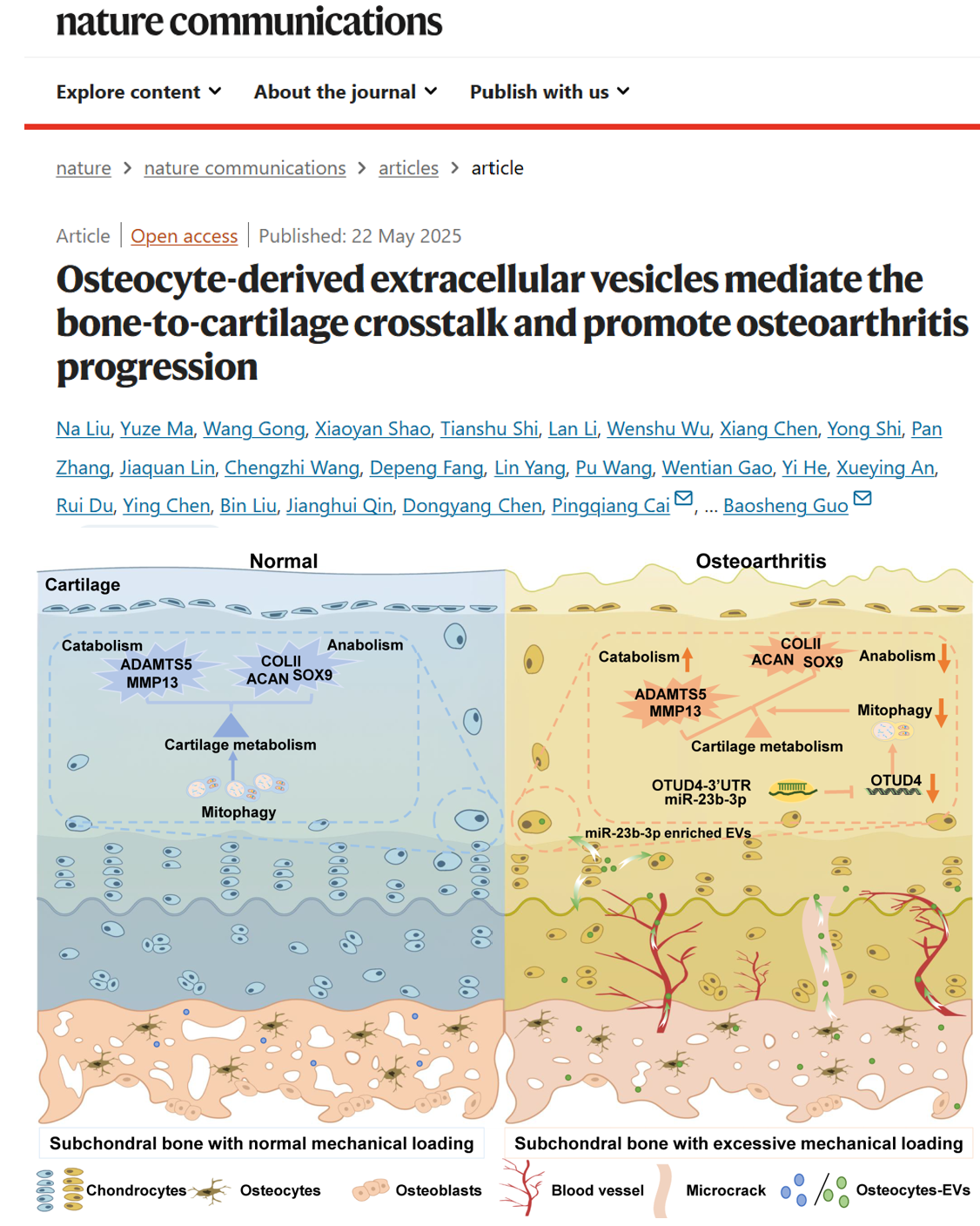
在该研究中,研究人员首先结合转录组学和有限元分析明确细胞外囊泡作为应力介导骨-软骨之间通讯的关键因子。随后,通过构建骨细胞特异性EVs示踪小鼠在体内观察到骨细胞来源的EVs能够转运至软骨细胞。进一步实验中,研究人员进行膝关节腔注射骨细胞来源EVs以及骨细胞靶向递送GW4869阻断骨细胞内EVs生成,发现了应力过载促进软骨下骨骨细胞分泌EVs加速软骨代谢紊乱和OA进展。
基于EVs包裹的miRNA分子调控受体细胞功能的理论,研究人员随后构建了骨细胞特异性Dicer敲除模型,系统评估了骨细胞中miRNA分子在软骨代谢调控中的作用。通过miRNA转录组测序和实时荧光定量PCR(Real Time Quantitative PCR, RT-qPCR)技术进一步明确了骨细胞来源EVs携带miR-23b-3p参与调控软骨代谢。接下来,研究人员采用腺相关病毒载体构建骨细胞特异性过表达或沉默miR-23b-3p小鼠模型,并结合转录组学与生物信息学,深入解析了miR-23b-3p在软骨细胞代谢调控中的具体作用机制。通过双荧光素酶报告实验进一步证实了miR-23b-3p通过靶向Otud4抑制线粒体自噬,从而加剧软骨代谢失衡,促进OA进展。最后,研究人员应用了基于骨细胞靶向药物递送系统的治疗策略,系统评估了其在OA治疗中的潜在作用效果,并结合miRNA干预策略,为后续临床转化研究奠定了基础。
参考文献:
Osteocyte-derived extracellular vesicles mediate the bone-to-cartilage crosstalk and promote osteoarthritis progression.Nat Commun 16, 4746 (2025). https://doi.org/10.1038/s41467-025-59861-5
外泌体资讯网 Nat Commun|南京大学郭保生教授团队:应力促进软骨下骨骨细胞分泌细胞外囊泡加剧软骨代谢紊乱和骨关节炎进展




