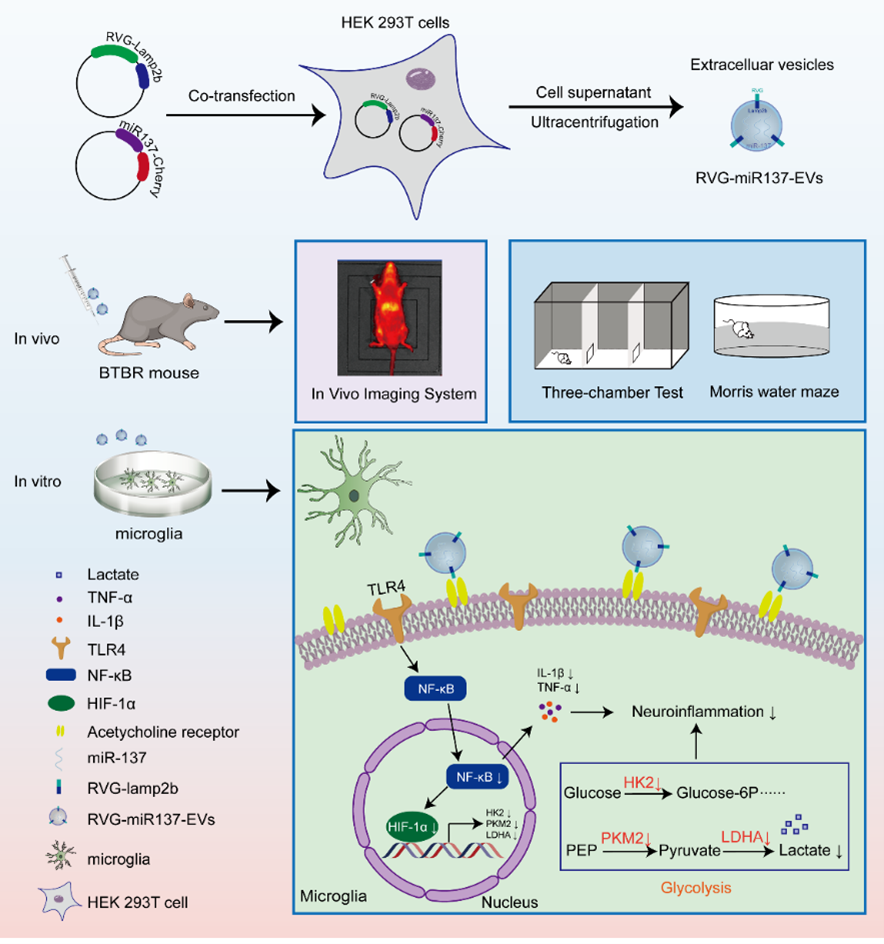
孤独症谱系障碍(Autism Spectrum Disorder,ASD)是一类具有高度异质性的神经发育障碍。最新研究发现,ASD患者脑组织中存在显著的糖代谢紊乱现象,其中糖酵解代谢途径的异常激活尤为突出,提示其可能在ASD的发生发展过程中起着关键作用。小鼠神经特异性敲除Mir137(Mir137flox/+; Nestin-cre),可呈现ASD的核心表型(社交障碍、刻板行为和认知缺陷)。然而,miR-137是否调控糖代谢重编程进而参与ASD的发生发展,目前尚未阐明。细胞外囊泡(Extracellular Vesicles,EVs)凭借其优异的生物相容性、高效递送能力以及跨越血脑屏障的优势,在神经系统疾病临床治疗中具有重要应用前景。然而,目前制约其临床转化的主要瓶颈在于EVs靶向特异性不足。狂犬病毒糖蛋白(Rabies Virus Glycoprotein,RVG)肽通过特异性结合脑内乙酰胆碱受体而表现出显著神经趋向性。因此,经RVG肽工程化修饰的细胞外囊泡(RVG-EVs)不仅可通过特异性脑靶向作用,显著增强EVs的血脑屏障穿透效率,而且其囊泡结构还可有效保护miR-137免遭核酸酶降解,显著维持其转录后调控活性。
2025年4月2日世界孤独症日,哈尔滨医科大学公共卫生学院儿少卫生与妇幼保健学梁爽/武丽杰团队在精神病学顶级期刊Molecular Psychiatry(中科院1区Top期刊,IF=9.6)发表题为“RVG engineered extracellular vesicles-transmitted miR-137 improves autism by modulating glucose metabolism and neuroinflammation”的高水平文章。该研究在哈尔滨医科大学儿童发育与遗传研究省重点实验室和教育部人类遗传资源保护与疾病控制重点实验室完成,梁爽教授、武丽杰教授为文章的共同通讯作者,博士研究生秦倩为第一作者。
研究团队首先在ASD患者外周血中发现miR-137表达显著降低。为验证这一发现,在ASD模型鼠的不同脑区和血清检测miR-137表达水平。结果显示,ASD模型鼠小脑组织和血清中miR-137表达均呈现一致性降低,这一结果与临床发现具有高度一致性。进一步的病理学研究发现,ASD模型小鼠小脑组织中存在以下特征性病理改变:小胶质细胞活化标志物Iba-1+表达显著上调,乳酸含量显著高于对照组,提示ASD模型鼠存在乳酸异常蓄积现象;此外,糖酵解关键限速酶(HK2、PKM2及LDHA)的表达水平均显著异常升高。基于上述发现,研究团队构建了一种过表达miR-137和脑靶向RVG肽的工程化修饰的细胞外囊泡递送系统(RVG-miR137-EVs)。尾静脉注射RVG-miR137-EVs后,不仅大大提高了ASD模型鼠脑内miR-137的靶向递送效率,还可有效抑制小胶质细胞的异常活化,缓解小鼠脑内乳酸过度蓄积的现象,进而改善ASD模型鼠的社交障碍和认知功能缺陷。
机制研究显示,miR-137通过直接靶向结合TLR4基因,抑制TLR4/NF-κB信号通路,进而下调HIF-1α介导的糖酵解过度激活和乳酸蓄积。值得注意的是,经药理学阻断糖酵解代谢途径或TLR4信号通路后,均可有效抑制小胶质细胞异常活化和糖酵解代谢异常。
该研究创新性地揭示miR-137通过靶向调控TLR4/NF-κB/HIF-1α信号通路,介导小胶质细胞糖酵解代谢重编程的分子机制,系统阐明了神经炎症与能量代谢紊乱的协同作用在ASD神经病理进程中的关键作用。本研究的科学价值主要体现在:1)理论创新性:首次确立miR-137/TLR4信号轴作为ASD治疗的潜在分子靶点,为解析ASD的分子机制提供了新视角;2)机制突破性:证实"代谢-免疫"交互调控网络在ASD病理进程中的核心作用;3)转化应用价值:建立的RVG-EVs递送系统,为开发基于miRNA的精准治疗策略提供了实验依据。这些发现不仅拓展了对ASD神经病理机制的认识,更重要的是为发展新型靶向治疗策略提供了理论支撑和技术平台,具有重要的临床转化意义。
参考文献:
RVG engineered extracellular vesicles-transmitted miR-137 improves autism by modulating glucose metabolism and neuroinflammation. Molecular Psychiatry. 2025 Apr 2. doi: 10.1038/s41380-025-02988-0.
外泌体资讯网 MOL PSYCHIATR | RVG肽工程化修饰的细胞外囊泡脑靶向递送miR-137介导糖酵解代谢重塑抑制孤独症神经炎症





