乳腺癌是女性最常见的恶性肿瘤之一,也是女性癌症死亡的主要原因之一。由于特殊的分子分型,三阴性乳腺癌(triple-negative breast cancer,TNBC)对内分泌和分子靶向治疗不敏感。研究表明,相较于非三阴性乳腺癌,TNBC处于更缺氧和饥饿的状态,这使得TNBC细胞始终保持较高的自噬水平。由此,自噬相关的干预有望成为TNBC治疗的新策略。环状RNA(circular RNAs,circRNAs)是一类不具有5‘末端帽子和3’末端poly(A)尾巴、并以共价键形成环形结构的单链RNA分子。与传统的线性RNA不同,circRNA分子呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解,更适合作为诊断标志物。同时,由于高稳定性和增强蛋白表达等优势,circRNA在疫苗开发、癌症免疫治疗、蛋白质替代治疗和基因编辑等方面具有广泛的应用价值。circRNA是RNA药物领域中一种很有前景的RNA形式,有望颠覆个性化治疗方法。近日,中国医学科学院肿瘤医院宋咏梅教授团队、中国人民解放军总医院胡毅教授团队的研究人员构建了TNBC细胞自噬模型,通过高通量测序发现并验证circEGFR(hsa_circ_0080222)为自噬相关circRNA。该研究首次报道了TNBC细胞来源的外泌体circEGFR能够提高受体细胞的自噬水平并促进其恶性表型的形成。相关内容以“Novel exosomal circEGFR facilitates triple negative breast cancer autophagy via promoting TFEB nuclear trafficking and modulating miR-224-5p/ATG13/ULK1 feedback loop”为题发表于肿瘤学经典期刊Oncogene上(doi: 10.1038/s41388-024-02950-4)。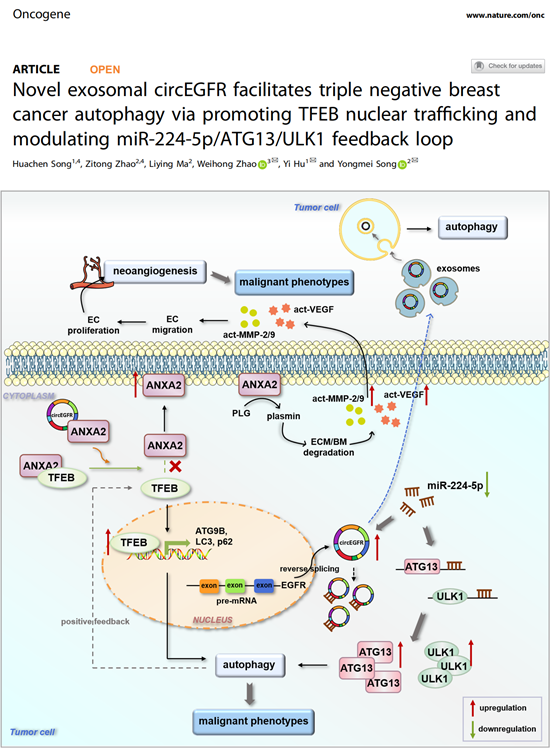
细胞自噬增加了肿瘤细胞在转移过程中的侵袭性和对应激条件的耐受性,这可能是TNBC相较于其它亚型更具侵袭性和更早复发的原因之一。研究人员通过氨基酸饥饿诱导TNBC细胞自噬并进行高通量测序,发现circEGFR在发生自噬的细胞中异常高表达,可促进TNBC细胞自噬流的活化。circEGFR在TNBC组织中表达上调,其高表达与淋巴结转移呈正相关。进一步研究发现,TNBC细胞来源的外泌体circEGFR可提高肿瘤微环境中受体细胞的自噬水平并促进其恶性表型的形成。circEGFR通过与ANXA2竞争性结合,阻断细胞质中ANXA2和TFEB之间的相互作用,使ANXA2-TFEB复合物解体,TFEB向细胞核的转位, ANXA2向细胞膜转位,导致TNBC细胞自噬和血管生成。同时,circEGFR作为海绵吸附miR-224-5p,增强miR-224-5p靶基因ATG13和ULK1的表达,也可导致细胞自噬水平升高。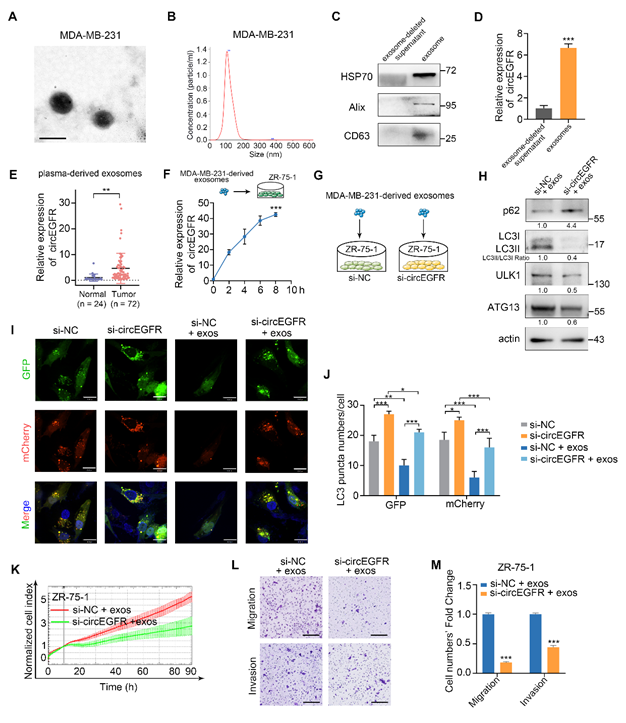
图2 外泌体来源的circEGFR促进肿瘤微环境中受体细胞的自噬过程该研究揭示了circEGFR调控细胞自噬促进TNBC恶性进展的新机制,提示外泌体circEGFR有望成为TNBC诊断生物标志物和治疗靶点,为TNBC的诊治拓宽了新思路。Novel exosomal circEGFR facilitates triple negative breast cancer autophagy via promoting TFEB nuclear trafficking and modulating miR-224-5p/ATG13/ULK1 feedback loop. Oncogene. Doi: 10.1038/s41388-024-02950-4. Online ahead of print.外泌体资讯网 Oncogene |新型外泌体来源circEGFR通过促进TFEB核转位以及调节miR-224-5p反馈环路促进三阴性乳腺癌自噬






