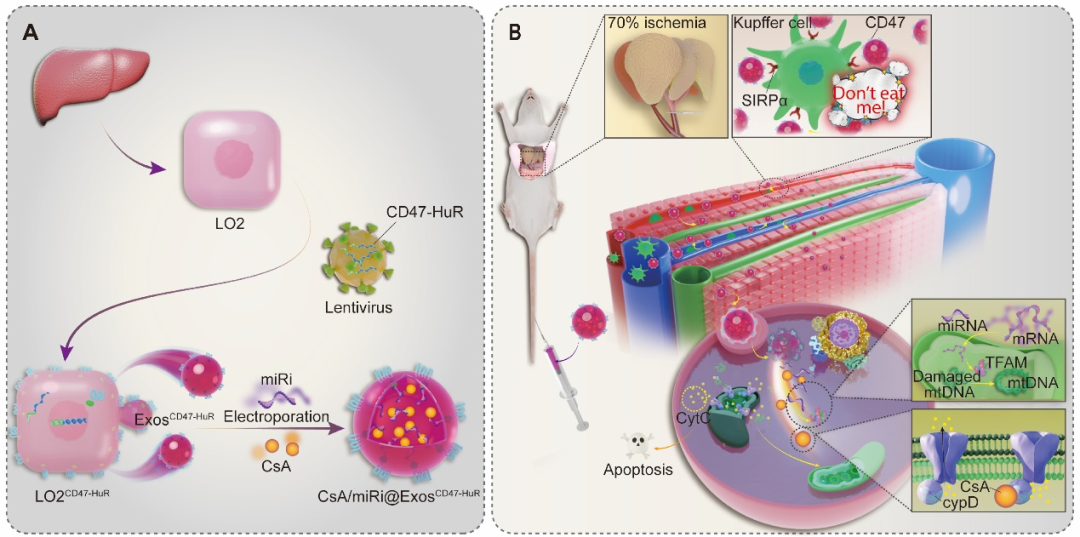
肝缺血再灌注损伤(Hepatic Ischemia/Reperfusion Injury,HIRI),这一在手术过程中不可避免的病理性损伤,依旧是围手术期患者并发并发症及死亡的重要原因之一。目前,缓解HIRI的主要挑战在于肝脏内存在大量的驻留巨噬细胞(Kupffer细胞)对药物的清除以及与其相关的病理生理机制的复杂性。
近日,重庆医科大学基础医学院蒋宁/彭奇龄/王建为团队在生物医学1区杂志Theranostics (最新 IF: 12.4)上发表题为“Reprogramming Exosomes to Escape from Immune Surveillance for Mitochondrial Protection in Hepatic Ischemia-Reperfusion Injury”的研究论文(2024 Jan 1;14(1):116-132),报道一种重编程的外泌体,具有良好的规避Kupffer细胞的免疫监测的能力,并通过运载多种干预措施实施多层次治疗策略。
线粒体在HIRI中扮演关键角色,参与能量代谢障碍、氧化应激、线粒体通透性转变和促炎因子释放等过程,对损伤的发生和发展具有重要影响。化合药物环孢素A(CsA)以其抑制线粒体通透性转换孔(mitochondrial permeability transition pore, mPTP)开放的能力而闻名,而线粒体转录因子A(mitochondrial transcription factor A, TFAM)通过调控线粒体DNA(mitochondrial DNA, mtDNA)的转录延伸,均被认为是维护线粒体稳态的重要靶点。
在此项研究中,研究人员通过重编程使外泌体过表达跨膜蛋白CD47这一“伪装斗篷”,与巨噬细胞膜表面SIPRα结合后释放“别吃我”的信号,逃逸免疫监视。此外,通过将HuR与CD47胞质侧融合,赋予外泌体以HuR的RNA结合功能,增加其携带讲TEFM过表达的miRNAi(miRi)能力。最后,采用电穿孔技术将外泌体作为化合药物环孢素A(CsA)的有效运载工具,实现了多层面治疗策略的综合实施。重编程的外泌体在成功逃逸免疫监视后,将其内部两种“货物”有效释放至肝细胞其中,从多个层面有效地保护了线粒体。这为应对HIRI提供了一种有前景的治疗策略,并在HIRI治疗中显示出安全有效的临床应用潜力。
该研究建立了一种新型的药物递送系统,向缺血肝细胞传递CsA和miRNA inhibitor以缓解HIRI。在逃避免疫监视后,重编程的外泌体可以在供氧/需氧失衡期间维持HIRI损伤中最关键的细胞,肝细胞的线粒体稳态。通过聚焦于保护线粒体,这种多功能药物可以预防HIRI导致的肝细胞死亡。因此,该研究结果为临床治疗HIRI提供了一种新颖的药物和基因调控组合策略。基于此,重新编程的药物递送系统精准传递药物的策略为治疗与线粒体损伤相关的疾病奠定了初步基础。
该论文通讯作者是重庆医科大学基础医学院蒋宁副教授及彭奇龄副教授、重庆医科大学附属第一医院肝胆外科杜成友教授以及周宝勇主治医师。博士后刘闪闪、硕士研究生肖新芋、博士研究生张腊与重庆医科大学基础医学院王建为副教授为该论文的共同第一作者。上述研究工作得到了国家自然科学基金、重庆市自然科学基金、重庆市教委基金以及重庆医科大学未来医学青年创新团队项目资助。
参考文献:
Reprogramming Exosomes to Escape from Immune Surveillance for Mitochondrial Protection in Hepatic Ischemia-Reperfusion Injury. Theranostics 2024; 14(1):116-132.
原文链接:https://www.thno.org/v14p0116.htm
外泌体资讯网 Theranostics丨重庆医科大学基础医学院蒋宁/彭奇龄/王建为:可逃避免疫监视的重编程外泌体保护线粒体缓解肝缺血再灌注损伤