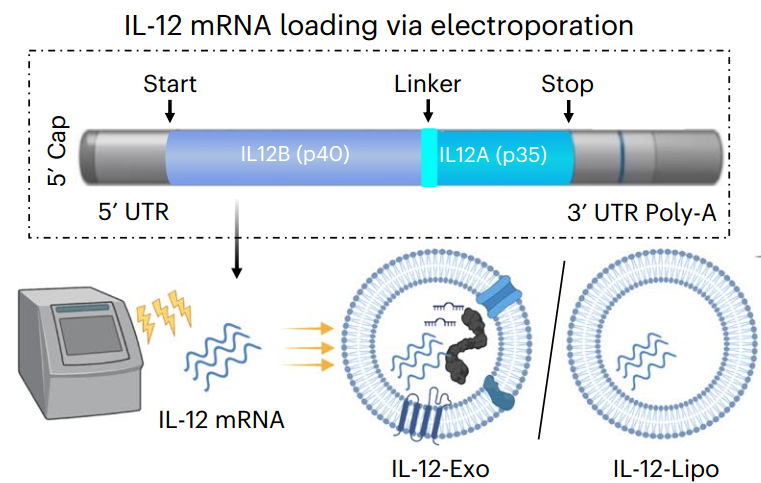
肺癌是世界上最常见的癌症之一,生存率也是最低的之一。细胞因子如白细胞介素-12(IL-12)已经表现出作为强大肿瘤抑制剂的潜力。然而,它们的应用受到脱靶毒性的限制。近日,哥伦比亚大学程柯教授团队在Nature Nanotechnology杂志发表文章,报告了一种通过吸入包含IL-12信使RNA的胞外囊泡治疗肺癌的策略。这是一种可吸入的治疗性癌症疫苗,即基于装载IL-12 mRNA的外泌体的IL-12-Exo。在小鼠肺肿瘤模型中,IL-12-Exo在6周的研究中实现了局部和全身的抗肿瘤免疫反应,而没有检测到毒性。
免疫检查点阻断疗法有望诱导肿瘤消退,但由于免疫抑制性肿瘤微环境(TME)的限制,其效果常常不尽如人意。这种限制促进了下一代免疫疗法的发展,包括重组细胞因子或趋化因子。这些药物可以促进T细胞的招募,将免疫“冷”肿瘤转化为“热”肿瘤。值得注意的是,白细胞介素-12(IL-12)刺激干扰素-γ(IFNγ)的产生,并增强免疫细胞,桥接先天和适应性免疫反应。尽管这些蛋白质的单药免疫反应或与其他免疫疗法的联合治疗,但全身细胞因子治疗可能会引起严重的副作用,正如早期临床试验所观察到的那样。因此,局部TME递送途径是必不可少的。
利用信使RNA(mRNA)可以确保局部翻译和原位疫苗接种,而不会出现与DNA相关的风险,例如基因组整合。编码IL-12的mRNA的肿瘤内(i.t.)注射是一种有前途的局部递送策略,已被转化为临床试验。然而,直接的内部器官损伤递送仍然是一个挑战。从脂质到聚合物纳米粒子,各种mRNA递送策略已经得到了探索,但脱靶效应和毒性仍然是关注的问题。细胞外囊泡,特别是外泌体,越来越多地被用作天然mRNA递送系统。通过吸入进行肺递送是一种有效的、非侵入性的局部给药途径,正如我们之前为治疗肺纤维化和COVID-19所证明的那样。
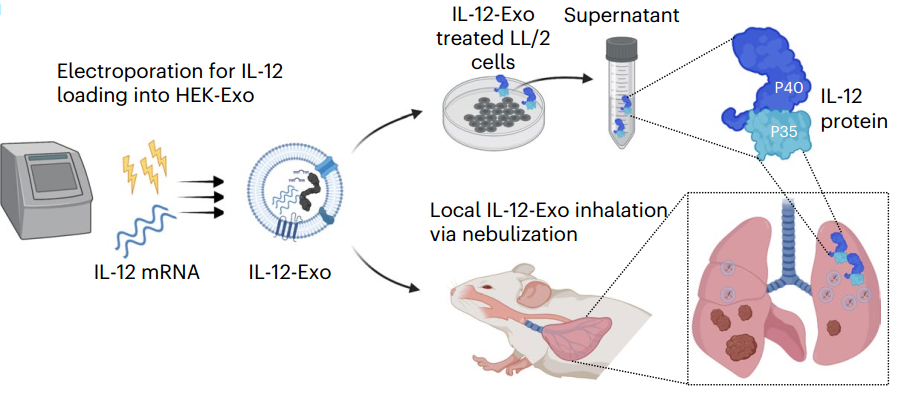
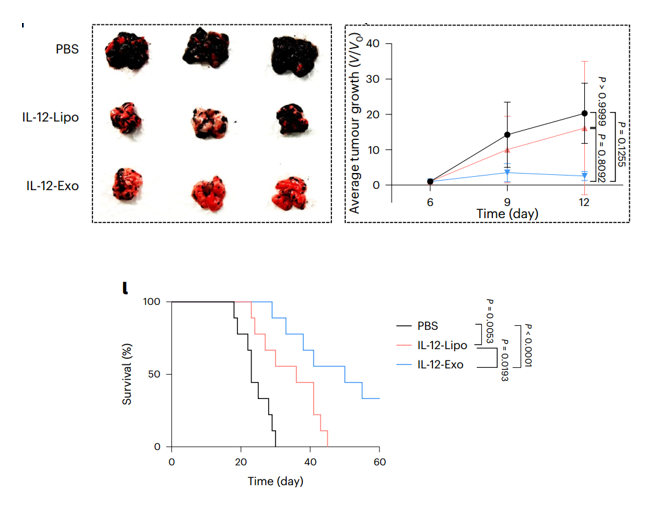
该研究开发了可吸入的胞外囊泡,其中装载了IL-12 mRNA,以解决肺癌问题,并在携带肺肿瘤的小鼠模型中增强全身免疫力。IL-12 mRNA通过电穿孔装载到人类胚胎肾细胞衍生的外泌体(HEK-Exo)中,产生装载IL-12 mRNA的外泌体(IL-12-Exo)。在肺肿瘤小鼠吸入后,IL-12-Exo在TME生物分布方面表现优于装载IL-12 mRNA的脂质体(IL-12-Lipo),并最小化全身毒性。这些吸入的IL-12-Exo促进了IFNγ介导的免疫激活、全身免疫和免疫记忆,最终导致肺肿瘤抑制和对肿瘤再挑战的高度抵抗。
吸入和癌细胞的优先摄取导致有针对性的递送和更少的全身副作用。IL-12信使RNA在先天和适应性免疫细胞群体中产生干扰素-γ的产生。这种激活在肿瘤微环境中引起强烈的激活状态,并增强其免疫原性。增强的免疫反应导致肿瘤细胞毒性免疫效应细胞的扩增、免疫记忆的形成、抗原呈递的改善和肿瘤特异性T细胞启动。该策略已在原发性肿瘤病变中得到证明,并提供了对随后肿瘤再挑战的深刻保护。这表明局部递送的基于细胞因子的免疫疗法有望解决原位和转移性肺肿瘤。
早期临床试验中,全身重组人IL-12的治疗导致严重的毒性。局部递送可以遏制这种“细胞因子风暴”,同时保留抗肿瘤效力。利用吸入这种非侵入性方法,该研究实现了直接治疗性递送到肺部,优于其他递送方式,如i.t.递送。该研究证实了成功将IL-12 mRNA局部递送到肺TME,将有毒的细胞因子定位到肿瘤病变。
吸入后,增强的IL-12表达主要通过CD8+ T细胞刺激IFNγ的产生,NKT细胞发挥了较小的作用。IFNγ中和完全废除了IL-12-Exo的肿瘤抑制作用。在LL/2原位肺肿瘤模型中,IL-12-Exo的保护性免疫反应主要依赖于CD8+ T细胞和部分NKT细胞,绕过了对CD4+ T细胞的需求。IL-12-Exo还促进记忆免疫细胞增殖,使其能够在再次挑战时拒绝肿瘤。淋巴结中的抗原呈递细胞群体和循环中表达肿瘤特异性抗原的CD8+ T细胞的活化群体,这可能是由IL-12信号或IFNγ介导的DCs或单核细胞的重编程所诱导的。另一个可能的原因是由IFNγ和Granzyme B产生的T细胞和NKT细胞引发的肿瘤细胞杀死后的肿瘤抗原和损伤相关分子模式释放的间接结果。这项研究中解释了IL-12的多效治疗机制。
该研究的限制。电穿孔虽然有效,但成本高,且在RNA封装到外泌体中的小规模应用方面受到限制。吸入可能不适合存在呼吸并发症的患者,而mRNA的短暂性质促使探索诸如自我扩增RNA等荷载以实现持续的细胞因子表达。总之,IL-12-Exo是一种强效的IL-12 mRNA递送系统,可与简单性和对原发肿瘤和转移瘤的疗效相结合。与脂质体对照相比,外泌体提高了IL-12的表达并减轻了毒性。作为一种非侵入性方法,吸入比肿瘤内注射有更好的患者遵从性。作为生物相容性囊泡,外泌体提供了多种RNA递送解决方案。因此,IL-12-Exo提供了一种前景广阔的抗癌治疗疫苗,基于外泌体的系统提示其在临床需求方面具有广泛的治疗潜力。
外泌体资讯网 【Nat Nanotechnol】程柯团队:可吸入细胞外囊泡递送IL-12 mRNA治疗肺癌并促进全身免疫