甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌最常见的病理亚型,其发病率近年来呈爆发式增长,多数PTC分化程度高,进展缓慢,10年总体生存率可高达90%。但是,PTC患者一旦出现远处器官转移,其AJCC分期从I期升级为IVB期时,死亡风险显著升高:10年总体生存率最高仅为51.4%,10年无进展生存仅为25%。目前,外泌体(exosomes)微小RNA(microRNAs,miRNAs)在恶性肿瘤远处转移起着重要作用,其对肿瘤远处转移的调控机制涉及多个方面,包括对肿瘤自身远处转移特性调控以及肿瘤微环境的调控。但是,目前exosomal miRNAs在PTC远处转移中的潜在作用及其机制仍是我们的知识盲区。
近日,四川大学华西医院雷建勇副教授团队在J Clin Endocrinol Metab上发表了题为“Exosome-mediated delivery of miR-519e-5p promotes malignant tumor phenotype and CD8+ T-cell exhaustion in metastatic PTC”的研究性文章(2023 Dec 11:dgad725)。该文揭示了PTC细胞通过exosomes分拣miR-519e-5p,一方面可以促进肿瘤细胞获得更恶性的表型,另一方面exosomal miR-519e-5p可以被远处转移器官内的CD8+ T细胞摄取并减弱其抗肿瘤免疫功能,从而促进远处转移。对肿瘤源性exosomal miRNAs在远处转移中双重作用的研究可提高我们对exosomes介导的远处转移机制的理解。
在这项研究中,研究团队首先从循环exosomal miRNAs着手,通过对测试组和验证组的循环exosomal miRNAs及其源细胞和受体细胞探索发现,PTC源性exosomal miR-519e-5p在远处转移性患者的循环系统中显著上调。进一步的实验表明,PTC细胞可以通过hnRNPA2B1介导的肿瘤抑制性miR-519e-5p分拣到exosomes中,PTC细胞内miR-519e-5p丰度降低使得其对PLAGL2基因的抑制作用减弱,从而激活Wnt信号通路获得更恶性的表型。此外,PTC源性exosomal miR-519e-5p通过循环系统转运至远处转移器官内CD8+ T细胞,通过下调NOTCH2基因抑制Notch信号通路促进肿瘤细胞在远处器官的免疫逃逸。
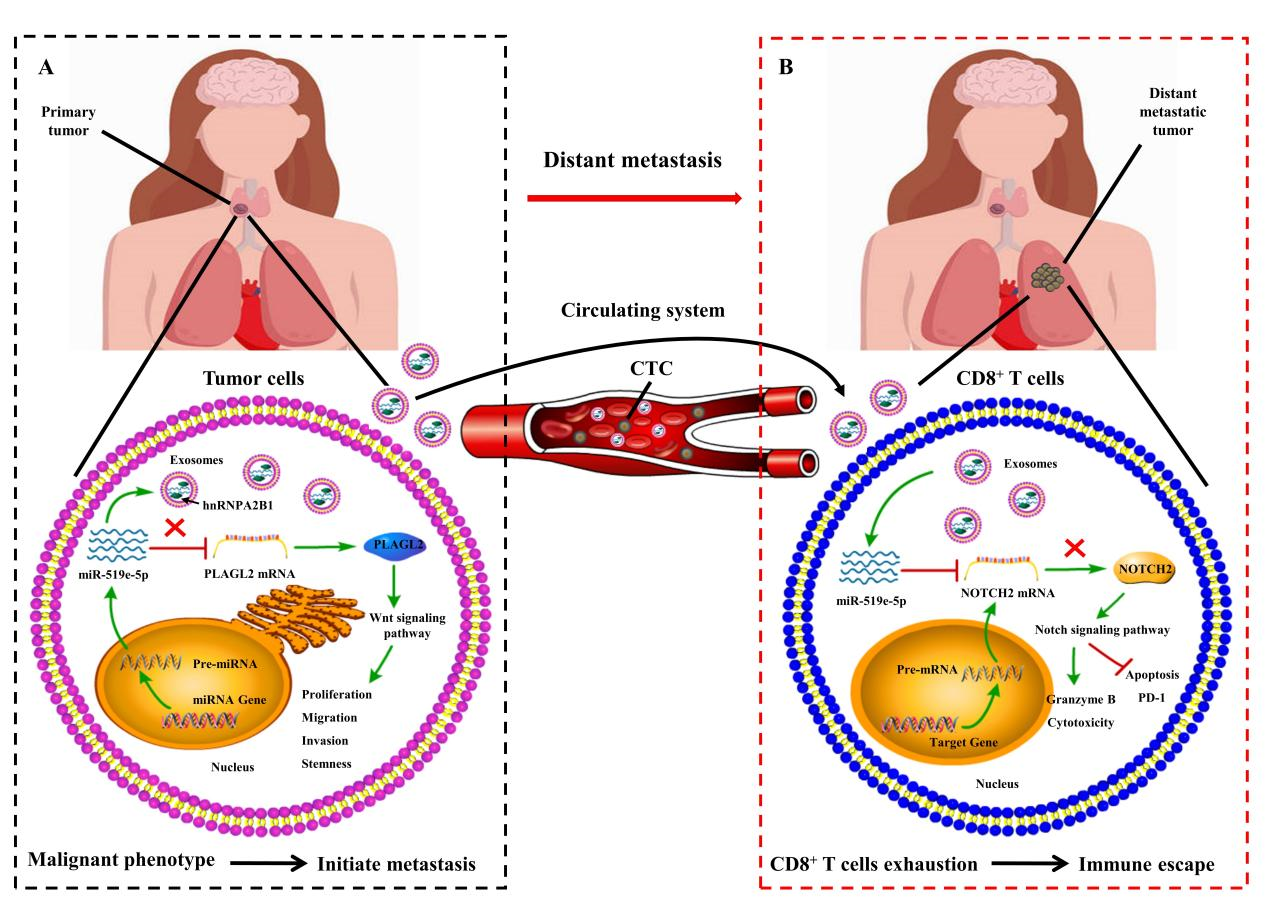 图A:PTC细胞通过hnRNPA2B1介导肿瘤抑制性miR-519e-5p分拣到exosomes以获得更恶性的表型图;B:PTC源性exosomal miR-519e-5p转运至远处转移器官内CD8+ T细胞促进肿瘤细胞免疫逃逸。
图A:PTC细胞通过hnRNPA2B1介导肿瘤抑制性miR-519e-5p分拣到exosomes以获得更恶性的表型图;B:PTC源性exosomal miR-519e-5p转运至远处转移器官内CD8+ T细胞促进肿瘤细胞免疫逃逸。
参考文献:
Exosome-mediated delivery of miR-519e-5p promotes malignant tumor phenotype and CD8+ T-cell exhaustion in metastatic PTC. J Clin Endocrinol Metab. 2023 Dec 11:dgad725. doi: 10. 1210/clinem/dgad725.
外泌体资讯网 J Clin Endocrinol Metab|四川华西医院雷建勇:外泌体促进转移性甲状腺乳头状癌的恶性肿瘤表型和T细胞耗竭





