细胞分泌细胞外囊泡(EVs)和非囊泡细胞外纳米颗粒(NVEPs或ENPs),在细胞间通讯中发挥作用。然而,肿瘤细胞内源性逆转录病毒可能会随着细胞外囊泡同时被分离,对树突状细胞的功能产生不同影响。肿瘤来源的不同EVs被认为能够诱导抗原呈递细胞的免疫启动或免疫抑制。这种差异的功能是由EV亚型和ENPs中组成成分的不确定而引起的。
来自法国巴黎文理研究大学的研究人分离了小鼠肿瘤细胞系分泌的EVs和ENPs,在许多肿瘤细胞产生的EV制备中鉴定出内源性小鼠白血病病毒的病毒样颗粒(VLPs)。在对EVs与VLPs和ENPs精准分离后发现,小型EVs和大型EV/VLP特异性诱导树突状细胞免疫功能上有不同的表现。相关内容以“Extracellular vesicles and co-isolated endogenous retroviruses from murine cancer cells differentially affect dendritic cells”为题发表于12月11日的国际著名分子和细胞生物学期刊EMBO Journal上。
细胞间通讯在所有组织中都至关重要,尤其是在肿瘤微环境中,肿瘤细胞必须作用于周围的基质和免疫细胞最终形成实体肿瘤。细胞可以通过可溶的分泌因子与细胞外介质进行通信,还可以通过细胞外囊泡(EVs)和其他非囊泡的细胞外纳米颗粒(NVEPs,在这里缩写为ENPs)进行通信。在过去的几年中,新型EVs的分离和检测技术的发展增加了我们对EVs/ENPs的异质性的了解,并强调了非囊泡的细胞外颗粒的新亚型的存在,如exomeres、supermeres和超分子攻击颗粒(supramolecular attack particles)。然而,除了后者显示杀伤活性外,对这些新发现颗粒的生物学功能仍知之甚少。此外,大多数情况下,我们所看到的EVs的功能实际上是各种EV亚型(混合的内源体释放的外泌体exosomes和质膜源性的ectosomes)、ENPs和其他被统称为污染物的成分(可溶蛋白质、脂蛋白等)的混合物所引起的,因此需要明确每种EV和ENP亚型的特定属性和功能。
病毒感染为囊泡分泌物带来了额外的复杂性。病毒依赖于宿主细胞的生物过程来生存并形成病毒颗粒。特别是,包膜病毒被包裹在宿主细胞源的脂质双层膜中,在HIV的情况下,会使用EV形成机制形成。因此,作为不具备复制自主能力的细胞源脂质双层封闭颗粒,包膜病毒可以被视为EVs的一种亚型。此外,病毒感染还导致与病毒一起产生非传染性颗粒,其中包含病毒组分,包括衣壳(称为病毒样颗粒,VLPs),并修改内源EVs的数量和组成,这些EVs也可能包含病毒组分。内源逆转录病毒(ERVs)是包膜病毒颗粒和修改的内源EVs的潜在来源。ERVs插入到高等生物的基因组中,但不一定是病理过程的一部分,因为它们通常是突变或被抑制的,因此不能形成传染性病毒颗粒。然而,在生理或病理条件下,它们的传染性可以恢复,例如在免疫缺陷模型或小鼠肿瘤中。
在肿瘤微环境中,肿瘤细胞通过EVs和ENPs的作用部分促使基质和免疫系统周围细胞发生变化。然而,肿瘤细胞释放的EVs/ENPs对免疫系统的实际影响存在争议:有证据显示由肿瘤抗原转移导致的免疫应答激活,反之亦然,存在免疫抑制功能。这种差异可能是由于这些研究中使用的不同分离方法和条件,导致了异质EVs、ENPs和相关污染物的不同组合,每种组合都具有其特定且有时是对立的功能。
肿瘤源性EVs(内源或通过生物工程制备)可以携带产生细胞的抗原,这些抗原可以是原生的,也可以是以MHC-I复合物形式呈现在EV膜上的肽段,并将其转移到树突状细胞(DCs),从而引发T细胞介导的抗肿瘤反应和肿瘤排斥反应。未成熟的DCs监测外周组织并具有高摄取能力。一旦它们捕获到抗原并感知到微环境,它们最终可以成熟并迁移到淋巴结,特别是如果它们检测到损伤、病原体或炎症分子。在那里,它们可以激活或耐受T细胞,这取决于感知到的信号。除了含有抗原外,有人提出EVs具有固有佐剂效应,这是由于存在损伤相关分子模式(DAMPs),这可能解释了为什么EVs在将抗原转移到抗原呈递细胞(APCs)方面比可溶蛋白更有效。然而,抗原转移能力或DAMPs是否由所有EV亚型或ENPs携带,还是只有一些特定类型,目前尚不清楚。
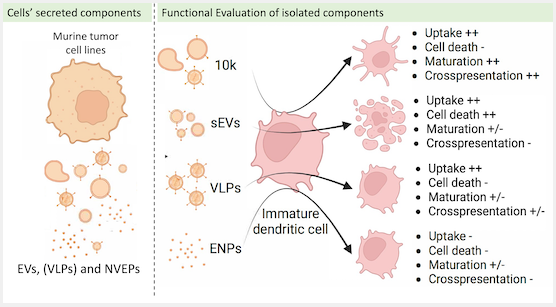
在这项研究中,研究人员首先通过对来自小鼠乳腺肿瘤细胞系EO771的EVs和ENPs进行表征来说明以上问题。研究人员在制备中发现了大量的包膜病毒样颗粒(VLPs),其中包括一些具有传染能力,确认这些VLPs是由内源性小鼠白血病病毒(MLV)产生的。在其他12个肿瘤细胞系中,也观察到了病毒gag蛋白或VLPs,但在两个肺癌细胞细和一个免疫活化的成纤维细胞系中未观察到。研究人员建立了一个可靠地将VLPs与其他小型EVs和ENPs分离的系统。研究人员通过定量蛋白质组学分析表征了肿瘤颗粒亚型,并分析了它们在体外转移抗原和激活树突状细胞的能力。结果显示,ENPs捕获效率较低,且不影响树突状细胞。VLP缺失的小型EVs在诱导特异性免疫反应方面有限。相反,大型EVs和VLPs的混合物显示了最高的免疫激活潜力,诱导树突状细胞成熟和抗原呈递效果最好。总的来说,这项研究重新评估了小鼠肿瘤产生的非病毒EVs和VLPs的相对比例和功能,以及它们对肿瘤进展的贡献。
参考文献:Extracellular vesicles and co-isolated endogenous retroviruses from murine cancer cells differentially affect dendritic cells. EMBO J. 2023;42(24):e113590.