在细胞间通讯中,外泌体(Exosomes)作为一种高效的传递信息的方式已经引起了广泛的关注。它们被牵涉到多种病理生理条件,从肿瘤免疫逃避到神经退行性疾病。然而,尽管外泌体在不同领域引发了极大的兴趣,但对其分泌机制的基本细胞生物学理解仍然不足。
近日,来自美国宾夕法尼亚大学郭巍教授课题组的研究人员发现,磷脂酰肌醇开关在这一过程中扮演了重要的角色。磷脂酰肌醇-3-磷酸(PI(3)P)被顺序转化为磷脂酰肌醇-4-磷酸(PI(4)P),引导Exocyst复合物的招募,从而促进外泌体的分泌。相关内容以“A phosphoinositide switch mediates exocyst recruitment to multivesicular endosomes for exosome secretion”为题在线发表于10月28日的国际综合性学术期刊Nature Communications上。
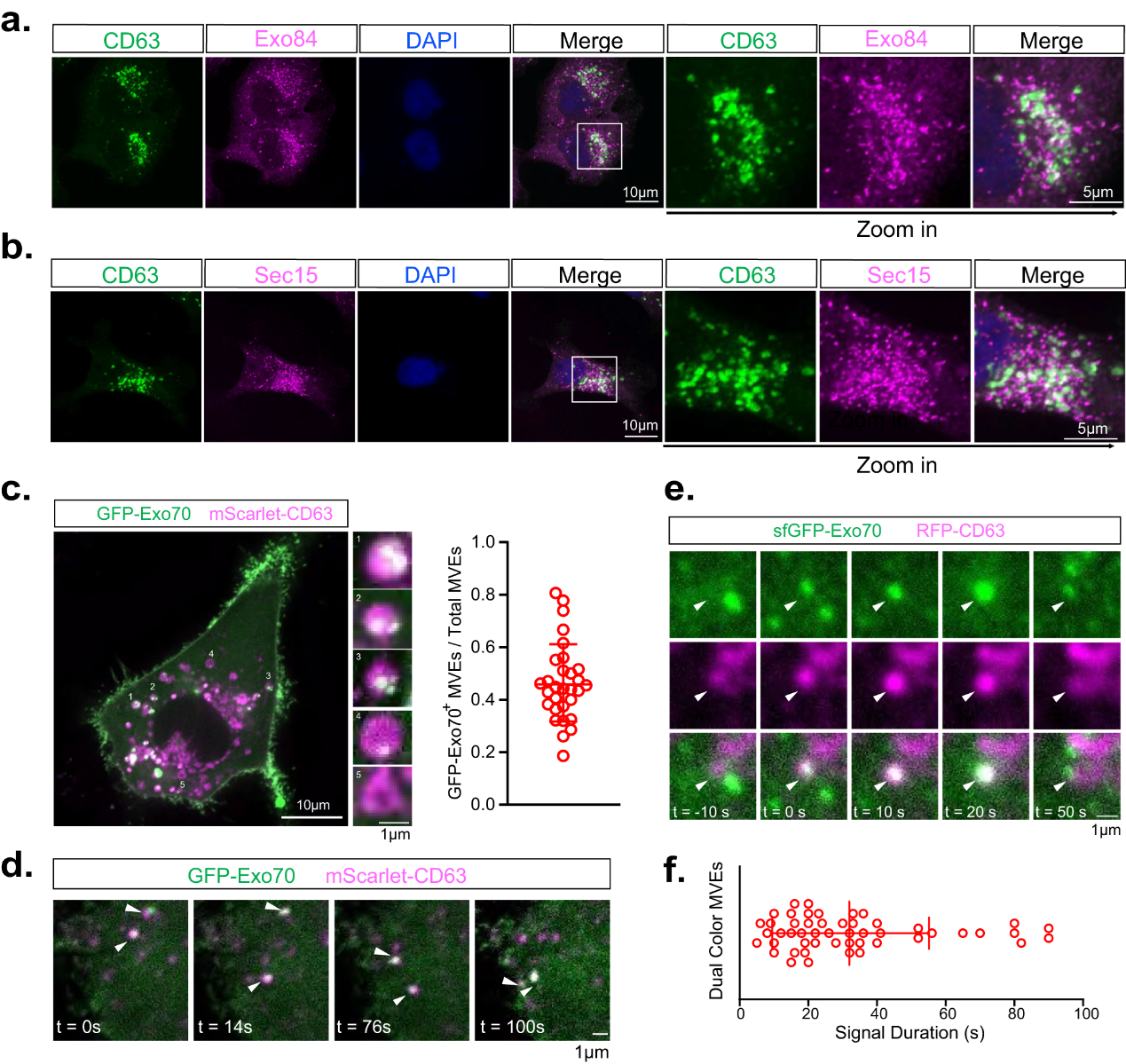
近年来,细胞外囊泡(EVs),尤其是外泌体,成为了高效的细胞间通讯方式。外泌体涵盖了从肿瘤免疫逃避到神经退行性等多种病理生理条件下的作用。尽管在不同领域对外泌体产生了极大的兴趣,但对外泌体分泌的基本细胞生物学理解相对不足。外泌体源自存在于多囊内体(MVEs)内的腔内囊泡(ILVs)。负责运输的内体分选复合物(ESCRT)招募内吞的载体并介导膜内陷,形成ILVs。随后,MVEs要么与溶酶体融合以进行降解,要么被运送到细胞边缘,与质膜结合并融合,将ILVs释放为外泌体。然而,一个关键的问题一直没有得到解答:是什么分子将MVEs引导到质膜以释放外泌体,而不是引导到溶酶体以进行降解?尽管以前的研究已经确定了小GTP酶Rab家族(例如,Rab27和Rab11)以及SNARE蛋白在外泌体分泌中的重要作用,但指导MVEs定位到质膜进行外泌体分泌的分子机制仍然未知。Exocyst复合体是一个由Sec3、Sec5、Sec6、Sec8、Sec10、Sec15、Exo70和Exo84组成的八聚蛋白复合物。来自酵母和哺乳动物细胞的研究已经确定,Exocyst定位和系着来自转高尔基网(TGN)的分泌小囊泡至质膜,并促进SNARE介导的融合。在外向运输和胞吐作用中,Exocyst亚基与SNARE蛋白以及Rab家族的小GTP酶,如Rab11和Rab27,相互作用,但Exocyst是否以及如何介导外泌体分泌仍然不清楚。除了蛋白质机械作用外,囊泡运输还受磷脂酰肌醇的控制。尽管内体和溶酶体区域的表面都被磷脂酰肌醇-3-磷酸(PI(3)P)和磷脂酰肌醇-3,5-双磷酸(PI(3,5)P2)标记,但外向运输通常需要产生磷脂酰肌醇-4-磷酸(PI(4)P)。已经报道PI4激酶,例如PI4KIIα和PI4KIIIβ,定位于内体和溶酶体,它们从磷脂酰肌醇(PI)中产生PI(4)P2。由于外泌体是从内体区域产生的,因此猜想,由PI4激酶产生PI(4)P有助于引导MVEs进行外向运输。在这项研究里,研究人员发现,由肌管蛋白酶1(MTM1)和PI4激酶类型PI4KIIα在MVEs表面顺序催化PI(3)P转化为PI(4)P,由此介导Exocyst复合物的招募。然后,Exocyst复合物将MVEs定位到质膜以进行外泌体分泌。进一步证明,破坏PI(4)P的生成或Exocyst复合物的功能会阻止程序性死亡配体1(PD-L1)的经外泌体分泌,并导致PD-L1在溶酶体中积累,而PD-L1是肿瘤细胞中的关键免疫检查点蛋白。该研究表明,MVEs上的PI(3)P到PI(4)P的转化以及Exocyst复合物的招募引导了MVEs外向运输和进一步的外泌体分泌。这一发现不仅增进了对外泌体分泌机制的理解,还为未来的疾病治疗和药物研发提供了潜在的目标。这项研究有望深化我们对细胞间通讯和疾病机制的认识,为新的治疗策略的开发铺平道路。参考文献:A phosphoinositide switch mediates exocyst recruitment to multivesicular endosomes for exosome secretion. Nat Commun. 2023 Oct 28;14(1):6883.