2019年起新型冠状病毒SARS-CoV-2的大范围爆发后,全球科研人员均迫切地寻找该病毒的发病机制、与人体的作用方式和潜在的治疗方法。细胞外囊泡(EV)是由各种细胞分泌的物质和功能载体,也有证据表面丙肝病毒可以劫持细胞释放EV的通路,通过EV装载复制的病毒释放到细胞外。那么,EV是否在SARS-CoV-2病毒感染和免疫反应中行使重要作用?
近日, 呼吸疾病国家重点实验室、广州医科大学附属第一医院联合深圳市第二人民医院团队、深圳泌码科技研发团队、瑞典Vesicode 研发团队进行了基于邻近编码技术的单EV水平上的蛋白组解析,通过人体100-plex蛋白与SARS-CoV-2病毒N蛋白的联合检测,解析出与病毒共定位EV亚群、人体EV亚群的蛋白图谱特征以及与感染相关的变化规律。相关成果发表在Frontiers in Immunology,研究论文题为“Proteomic profiling of single extracellular vesicles reveals colocalization of SARS-CoV-2 with a CD81/integrin-rich EV subpopulation in sputum from COVID-19 severe patients”(DOI:10.3389/fimmu.2023.1052141)。
图1 图片摘要
研究人员从COVID-19重症患者痰液样本中分离出EVs,通过电子显微镜观察到囊泡状小体与SARS-CoV-2 病毒颗粒的共存现象(图1);该EVs样本亦会导致健康细胞以病毒感染方式死亡,表明人体细胞分泌的EV参与到了病毒和宿主的相互作用。
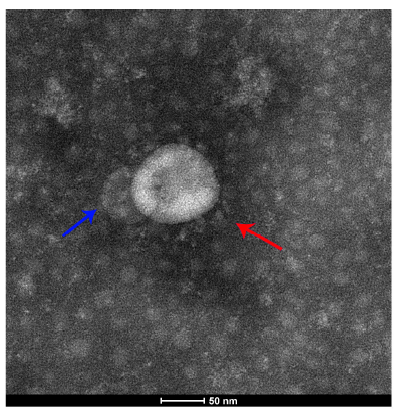
图1.透射电镜观察到的新冠病毒与囊泡的共定位
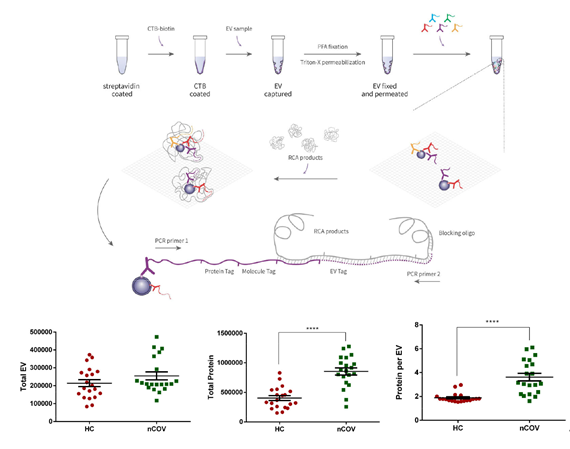
邻近编码技术(PBA)通过亲和捕获5微升痰液样本中的EVs,检测后发现EV数量在SARS-CoV-2感染后趋于稳定,而携带的蛋白质数量显著上升,患者痰液组平均每个EV携带3.6个蛋白质,高于健康组的1.9蛋白质/EV(图2)。
图2. 上:邻近编码技术原理;下左:在健康人与新冠患者痰液中细胞外囊泡PBA检测中的囊泡数量;
下中:蛋白携带数;下右:平均每个囊泡的蛋白数
COVID-19患者痰液样本EVs中IL6和TGF-β的表达与SARS-CoV-2 N蛋白表达有强相关性;且感染SARS-CoV-2后,多种蛋白的表达也显著增加,包括T细胞活化标志物CD26,人白细胞抗原HLA-A和粘附分子MAdCAM-1等等;以上现象表明,EVs在COVID-19的免疫反应中发挥作用(图3)。
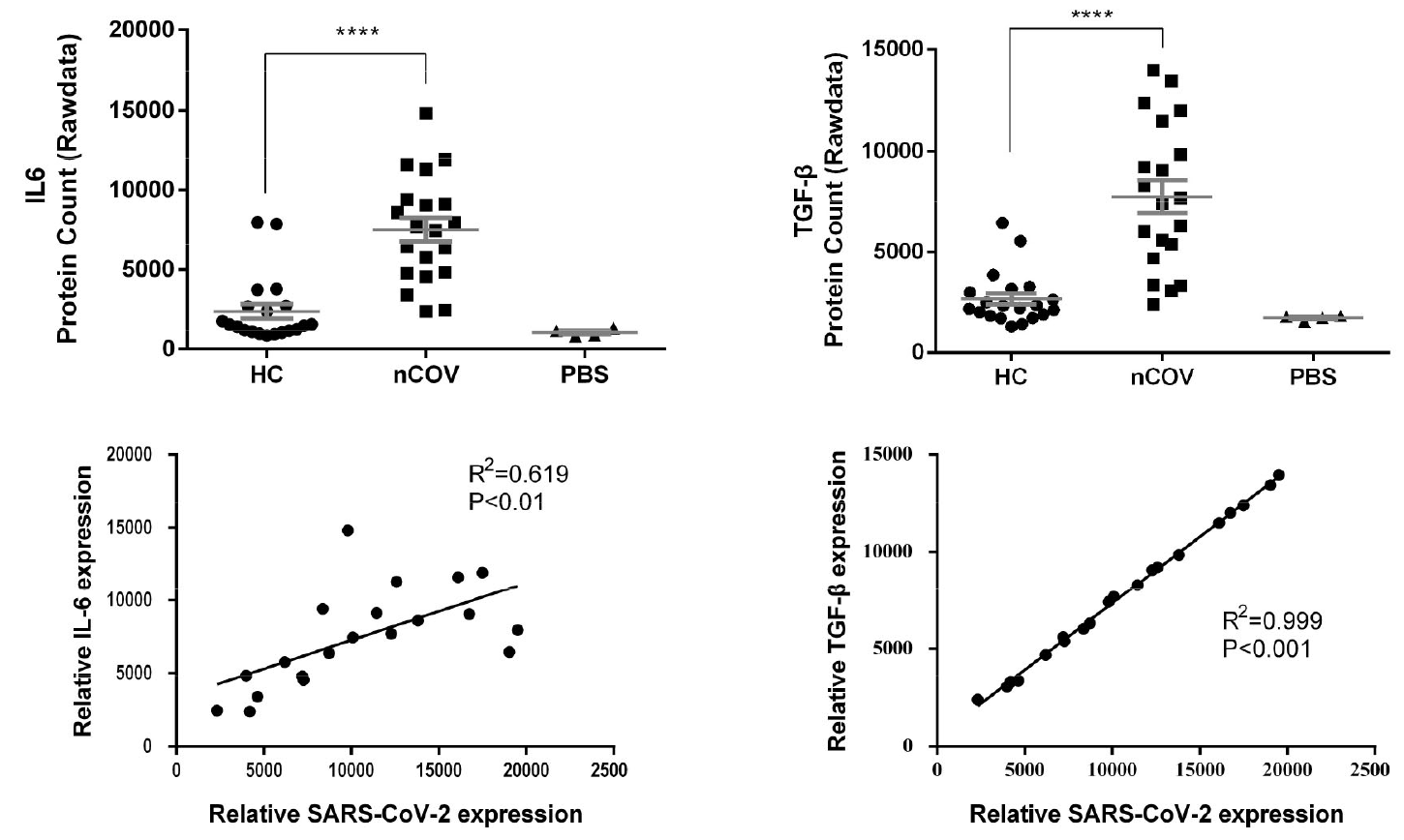 图3. IL6与TGF-β的表达在新冠重症患者的痰液囊泡中显著上升,且与SARS-CoV-2 N蛋白表达量有强相关性
图3. IL6与TGF-β的表达在新冠重症患者的痰液囊泡中显著上升,且与SARS-CoV-2 N蛋白表达量有强相关性
通过PBA检测单EV水平的蛋白表达,研究人员采用亚群聚类后的t-SNE图展示了新冠患者组和健康组EV亚群蛋白组学差异,其中有18个clusters表现出显著差异;而差异化最为显著的cluster2的EVs亚群中检测出大量的SARS-CoV-2 N蛋白,表明这些EVs可能与SARS-CoV-2病毒直接作用,或者是由病毒复制的细胞分泌的,且CD81、EPCAM、SNAI2以及多种细胞粘附分子在这类EVs中高表达(图4),另外含有EGFR和IgA的囊泡在新冠患者痰液中占比显著下降。
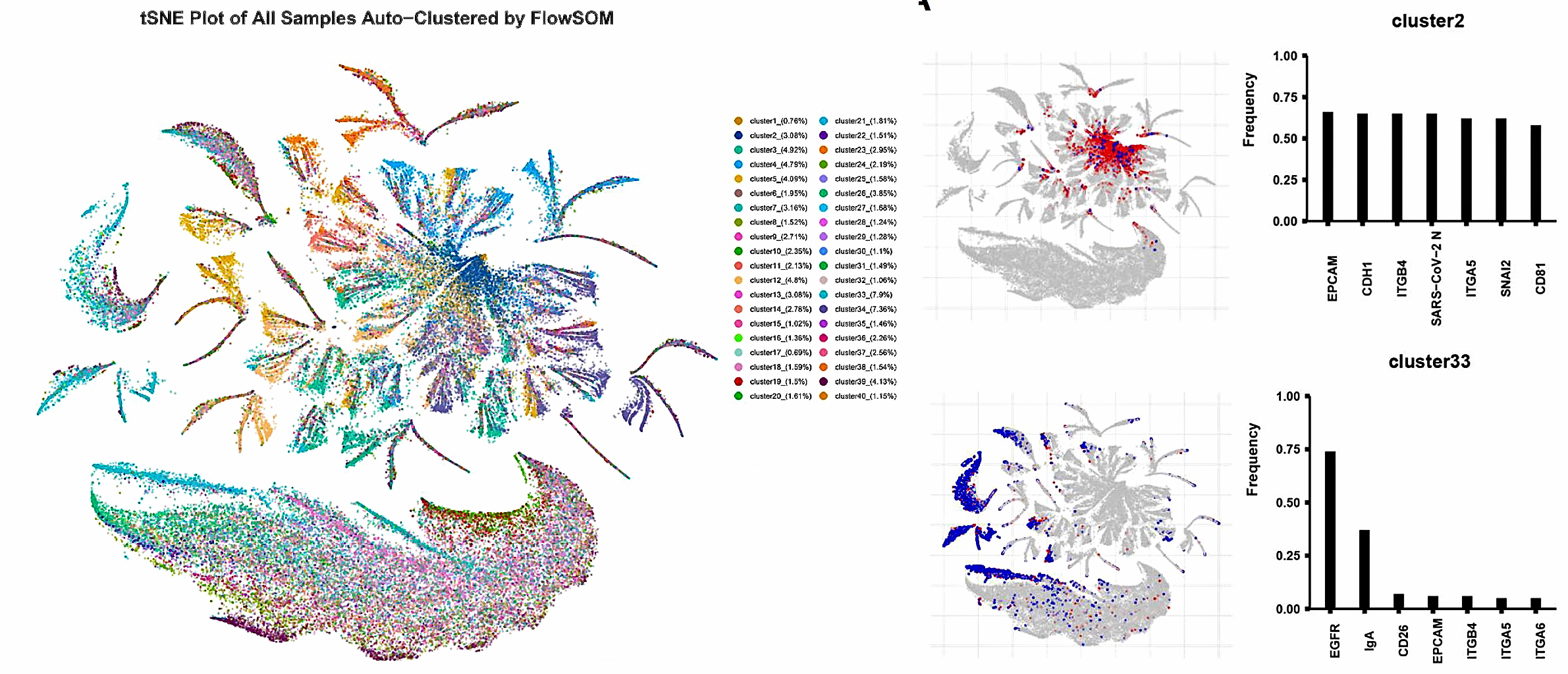
图4. 邻近编码技术检测单EV蛋白表达后,单EV聚类分析形成40个EV亚群,其中有18个亚群在新冠组和健康组中有差异。例如,亚群2为新冠组特征亚群,新冠病毒的N蛋白与EPCAM,CD8及一系列细胞粘附因子共定位;亚群33为健康组特征亚群,以EGFR和黏膜IgA为特征。
为了研究病毒蛋白和EVs的共定位关系,文章中进一步分析了SARS-CoV-2 N蛋白与单个EV其他蛋白质的组合情况。在调控EVs的标志物中,我们发现CD9、CD63、CD81和Alix与SARS-CoV-2 N蛋白存在共表达,其中受CD81调控的EVs更有可能与SARS-CoV-2 N蛋白结合。此外,研究发现cluster2、4、6、7、12和34是SARS-CoV-2感染后高表达的EV亚群,而CD81在这些EV中高表达;尤其cluster4的蛋白质矩阵显示CD81的表达异常高。这些结果表明,受CD81调控的EVs亚群是最有可能在SARS-CoV-2感染后引起肺部微环境变化的亚群(图5)。
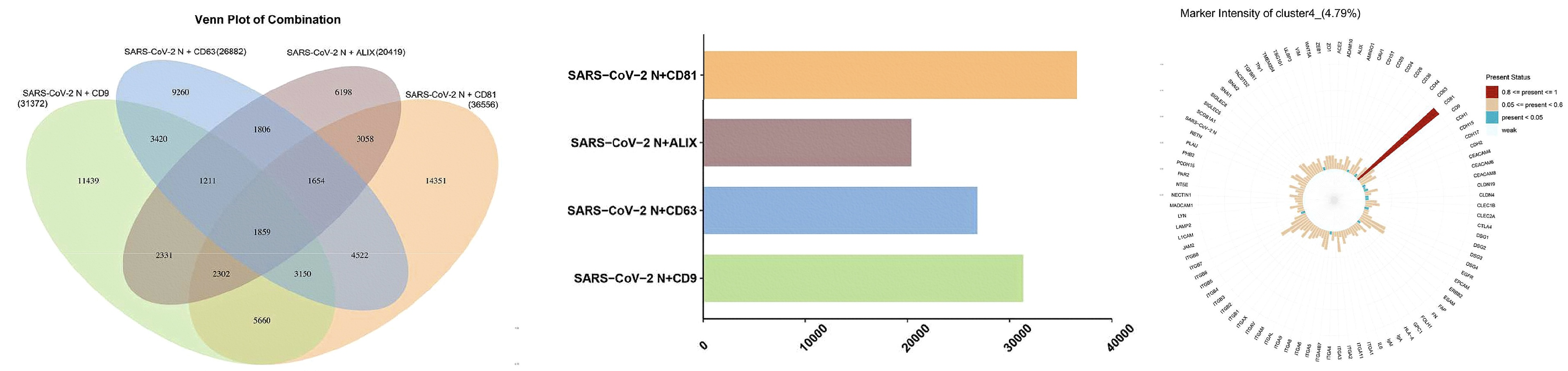
图5
综上所述,EVs参与COVID-19与人体的相互作用,病毒感染也会刺激EVs的分泌和成分变化;此外,EVs参与SARS-CoV-2的免疫反应,CD81调节的EV亚群最有可能与SARS-CoV-2感染后肺部微环境的变化相关,因此可以考虑开发表达CD81的vesicle-like纳米材料抗体药物;从理论上来讲,在体内这些囊泡会更倾向于与SARS-CoV-2融合,以达到干预的效果。综上所述,这项工作提供的数据可能有助于进一步研究COVID-19,并增加我们对疾病发病机制的理解。
参考文献:
Proteomic profiling of single extracellular vesicles reveals colocalization of SARS-CoV-2 with a CD81/integrin-rich EV subpopulation in sputum from COVID-19 severe patients. Front. Immunol. 14:1052141. doi: 10.3389/fimmu.2023.1052141
外泌体资讯网 Front Immunol|呼吸疾病国重等合作团队:单囊泡水平上解析新冠重症患者痰液中与SARS-CoV-2病毒共定位的囊泡亚群