1型糖尿病(T1D)的发病率逐年增加,并且呈现年轻化趋势。T1D主要源于自身反应性T细胞浸润至胰腺对胰岛β细胞进行攻击,导致胰岛素分泌不足,进而引起机体血糖上升。目前的治疗方法主要包括人工注射胰岛素、胰岛移植等,但面临低血糖、胰岛供体不足和药物脱靶效应等问题。近年来,间充质干细胞分泌的细胞外囊泡(MSC-EVs)对自身免疫性疾病的积极治疗效果引起了广泛关注,可能为T1D治疗提供潜在新策略。
近日,南开大学王悦冰团队在利用工程化MSC-EVs治疗T1D方面取得新进展,最新在国际权威学术期刊Small上发表题为“Engineered Cytokine-Primed Extracellular Vesicles with High PD-L1 Expression Ameliorate Type 1 Diabetes”的文章(2023 May 20;e2301019)。该团队首次利用炎症因子赋能MSC-EVs后,通过负载FDA批准的小分子药物5-氨基乙酰丙酸己酯盐酸盐(HAL),实现了T1D成像治疗一体化。构建的H@TI-EVs长期治疗体系不仅在T1D小鼠中具有良好的损伤胰腺靶向能力,而且通过调控PD-L1/PD-1轴发挥优异的免疫抑制和治疗能力。
基于该课题组前期EVs的研究基础(ACS Nano,2019;ACS Nano,2020;ACS Nano,2022),针对MSC-EVs在T1D中体内动态变化不明、治疗效果偏低等问题,该团队提出利用炎症因子TNF-α和IFN-γ处理MSCs,触发其“短期记忆”效应,提高其分泌MSC-EVs的免疫抑制及损伤修复能力,再负载兼具成像和抗炎作用的小分子药物HAL,构建了工程化H@TI-EVs纳米体系。体外实验结果表明,H@TI-EVs具有更好的免疫抑制、抗炎和抗凋亡能力。在T1D小鼠体内,通过HAL分解产物原卟啉IX(PpIX)介导的荧光成像,研究者动态观察到H@TI-EVs特异性靶向损伤胰腺,在损伤胰岛聚集。在此基础上,分别对T1D小鼠进行长期(H@TI-EVs-l)和短期(H@TI-EVs-s)治疗,发现H@TI-EVs长期治疗组可以显著降低T1D小鼠的血糖水平,促进胰岛素的分泌,恢复T1D小鼠的血糖调节能力。进一步研究发现,H@TI-EVs-l通过调控PD-L1/PD-1信号通路抑制CD4+ T细胞活化,降低胰腺中T细胞的浸润水平。而且该纳米体系还有效降低了胰腺中巨噬细胞募集,并诱导巨噬细胞M1型到M2型的转变,有效重塑了免疫微环境。这项研究构建的工程化EVs体系易于制备,具有良好的生物安全性、相容性及治疗效果,为T1D的临床治疗提供了新思路及重要理论实验基础。该研究得到了国家自然科学基金和国家重点研发计划的资助,构建的工程化EVs体系已申请国家发明专利。
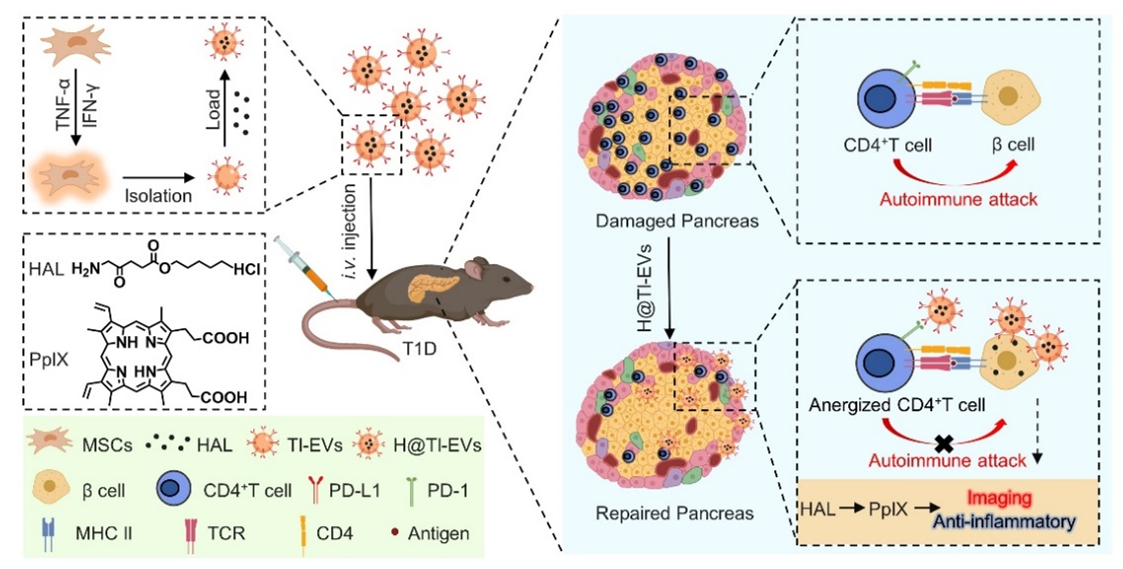
H@TI-EVs 在T1D小鼠体内实现成像治疗一体化参考文献:Engineered Cytokine-Primed Extracellular Vesicles with High PD-L1 Expression Ameliorate Type 1 Diabetes. Small. 2023 May 20: e2301019. doi: 10.1002/smll.202301019.





