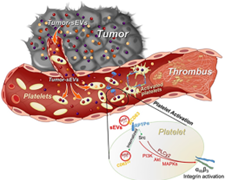
血栓是癌症患者的主要并发症之一,常常导致死亡。然而,血小板过度活化的机制尚不清楚。近日,Circ Res杂志上的一篇报道发现,肿瘤通过sEV与血小板进行通信,这些sEV传递肿瘤标志物并以CD63依赖性方式激活血小板,从而导致血栓形成。
血栓形成是癌症患者主要并发症之一,也是导致死亡的主要原因之一。据估计,高达30%的静脉血栓栓塞病例与癌症有关,而转移性癌症的风险更高。血小板与肿瘤进展之间的相互关系已经建立了100多年,但是这种关系的机制仍然不清楚。由于血栓形成,每年影响大量患者,并决定患者的发病率和与疾病相关的死亡率,因此了解所有癌症相关血栓形成的机制对于开发更好的靶向治疗非常重要。癌症通过产生促凝血微泡、粘附分子和细胞因子来促进前凝血状态。肿瘤微泡是一种具有独特形态特征和功能的小型异质性膜结合囊泡。其中最好特征化的一种是外泌体,它们是在多囊内体中产生的30到150nm的囊泡。在各种癌症患者的血浆中检测到了很高水平的循环外泌体。肿瘤外泌体可能携带有助于转移的癌症特异性脂质、蛋白质和核酸。大多数外泌体纯化方法都会分离出异质性来源的细胞外囊泡(EVs),包括直接从质膜上芽生的外泌体。为了准确和清晰,我们将外泌体称为小型细胞外囊泡(sEVs),即根据MISEV 2018标准小于200 nM的囊泡。目前治疗癌症血栓的方法是使用抗凝剂,但这可能会导致出血并延迟或中断化疗,降低患者的生活质量。因此,及时识别血栓高危癌症患者对于成功治疗至关重要。然而,不幸的是,血栓经常在尸检时才被发现。研究发现,血小板优先积累肿瘤分泌的细胞因子和生长因子,并将其浓缩到比血浆高104倍。研究假设这些被隐藏和保护在血小板内的肿瘤因子是通过肿瘤释放的sEVs运输,导致血小板激活。该研究展示了血小板在体外和体内通过sEV-四跨膜蛋白CD63摄取癌细胞来源的sEVs,并描绘了导致血小板激活的途径。血小板积累了癌细胞来源的mRNA,这可能作为癌症患者前凝血状态的预测标志。示意图描绘了循环中癌症-sEVs介导的血栓形成机制方法和结果:分离小鼠和人类血小板,并用来自各种癌细胞系的小型细胞外囊泡(sEVs)进行处理。证明了血小板非常有效地摄取来自侵袭性前列腺癌细胞的sEVs。摄取过程快速,在小鼠循环中有效进行,并由丰富的sEV-膜蛋白CD63介导。癌症-sEV的摄取导致体外和体内血小板中癌细胞特异性RNA的积累。人前列腺癌-sEV特异性RNA标志物PCA3在约70%的前列腺癌患者的血小板中检测到。前列腺切除术后,这显著减少。体外研究表明,癌症-sEV的摄取以CD63-RPTPα(受体样蛋白酪氨酸磷酸酶α)依赖性方式诱导强烈的血小板激活。与生理激动剂ADP和凝血酶相反,sEV通过依赖于活性翻译的非规范机制激活血小板。体内实验表明,在小鼠肿瘤模型和接受静脉注射癌症-sEVs的小鼠中均加速了血栓形成。通过阻断CD63来拯救sEV的前凝血作用。该研究展示了一种新的sEV介导的癌症-血小板通讯机制,涉及癌症小型细胞外囊泡(sEVs)上的CD63和血小板上的RPTPα(受体样蛋白酪氨酸磷酸酶α),并导致癌症标志物在血小板中的积累、它们的高反应性和血栓形成。血小板有选择地摄取恶性细胞的sEV,从而积累肿瘤标志物。前列腺癌标志物PCA3存在于前列腺切除术前的前列腺癌患者的血小板中,而术后没有,这表明了血小板中癌症-sEV标志物在癌症检测和预测血栓事件方面的价值。癌症-sEV摄取通过涉及sEV上的CD63和血小板RPTPα的新机制发生,导致血小板激活和随后的血栓形成。使用抗CD63抗体干扰这种机制可以预防体内sEV摄取和血栓形成。该研究表明sEV-CD63是治疗和预防癌症患者血栓形成的潜在有效治疗靶点。Dudiki T, Veleeparambil M, Zhevlakova I, Biswas S, Klein EA, Ford P, Podrez EA, Byzova TV. Mechanism of Tumor-Platelet Communications in Cancer. Circ Res. 2023 May 5. doi: 10.1161/CIRCRESAHA.122.321861. PMID: 37144446.外泌体资讯网 【Circ Res】EVs——肿瘤-血小板通讯的机制