胃癌是我国常见的消化道恶性肿瘤,淋巴结转移是公认的胃癌预后独立危险因素。早期胃癌诊断常以区域淋巴结转移为主,但发生淋巴结转移的胃癌患者预后差且快速恶性进展的分子机制目前仍不明确,临床治疗尚缺乏有效诊疗分子靶标。
近日,江苏大学王梅教授团队在Cancer Cell International发表了题为"Gastric cancer cell-originated small extracellular vesicle induces metabolic reprogramming of BM-MSCs through ERK-PPARγ-CPT1A signaling to potentiate lymphatic metastasis" 的研究论文(DOI:10.1186/s12935-023-02935-5)。该研究从微环境细胞代谢重编程的角度揭示胃癌淋巴结转移恶性进展的新分子机制,有望为胃癌淋巴结转移的诊断和治疗提供潜在分子靶标。文章通讯作者为江苏大学医学院检验医学系王梅教授,第一作者为江苏大学临床检验诊断学专业硕士研究生黄佳颖。
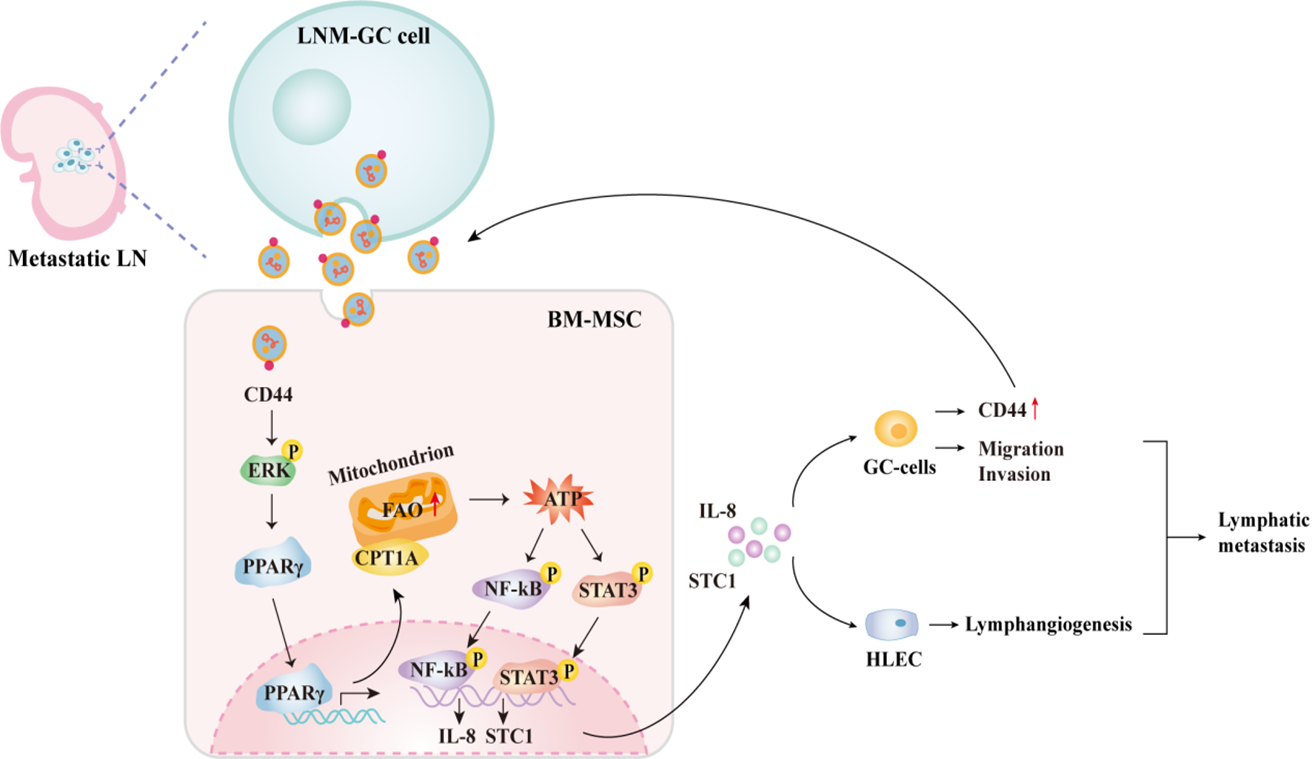
众所周知,骨髓来源的间充质干细胞(BM-MSCs)广泛参与肿瘤微环境形成,与肿瘤转移调控密切相关。该研究采用体内连续传代法构建淋巴结高转移胃癌细胞HGC-27-L,发现胃癌细胞来源小细胞外囊泡sEV可显著驯化BM-MSCs向肿瘤MSC转分化,这种驯化能力与其自身淋巴结转移能力呈正相关,并且该过程依赖于BM-MSCs脂肪酸氧化(FAO)代谢重编程。蛋白组学检测及验证证实CD44在淋巴结转移胃癌细胞sEV中高度富集,sEV内CD44通过ERK/PPARγ/CPT1A信号轴调控BM-MSCs的FAO代谢。ATP作为FAO的重要代谢产物,通过激活STAT3和NF-κB信号促进驯化后BM-MSCs 分泌释放促癌因子IL-8和STC1,进而增强胃癌细胞迁移、侵袭能力和淋巴管形成并上调胃癌细胞及其sEV中CD44的含量,在胃癌细胞与BM-MSCs间形成了一个持续性相互作用的正反馈回路。临床样本检测分析及TCGA等数据库生物信息学分析证实了参与胃癌细胞sEV-CD44促进BM-MSCs FAO代谢重编程的关键分子在临床胃癌组织及基质细胞中异常表达并与患者预后及淋巴结转移高度相关。该研究的发现将为胃癌淋巴结转移诊断提供潜在检测指标及治疗分子靶标。
外泌体资讯网 Cancer Cell Int|江苏大学王梅: 肿瘤细胞来源小细胞外囊泡通过调控骨髓间充质干细胞代谢重编程促进胃癌淋巴结转移





