由于血脑屏障(blood brain barrier, BBB)和血脑肿瘤屏障(blood brain tumor barrier, BBTB)的存在,药物无法有效地蓄积在脑胶质瘤病灶部位。BBB/BBTB 和胶质瘤细胞上还表达有药物外排转运蛋白(如 P-糖蛋白),大部分药物都是它们的底物。这些外排蛋白可以有效地将这些药物排出细胞外,或从一开始就阻止药物的进入。为了克服这一障碍,目前的临床前研究集中于转运蛋白抑制剂的开发,但临床试验仍未表现出令人满意的结果。起初,局部递送药物被认为是绕过 BBB/BBTB 的最佳方式,由此出现了鞘内给药、脑室内给药和对流增强递送(convection-enhanced delivery, CED)等侵入性的给药策略,但这些策略往往操作不便,还可能会给患者造成多次伤害。随着纳米技术的高速发展,各式各样的纳米药物递送系统逐渐成为治疗脑胶质瘤的高效策略。
外泌体(Exosome,EXO)的独特理化性质使其可以作为药物递送载体治疗疾病。与脂质体结构相似,其内部空腔可以负载大量水溶性物质,而磷脂双层膜中间的疏水区可以负载疏水性物质。稳定的双层膜结构可以保护其负载的货物在到达疾病靶部位处免受水解,并且其在体内可以被完全降解。由于 EXO 是内源性物质,所以相比于其它常用的纳米载体具有更低的免疫原性,并且能够逃避单核巨噬系统的吞噬,从而实现在体内的长循环。构成 BBB/BBTB 的 BMVECs 和胶质瘤细胞的细胞膜上都表达有丰富的转铁蛋白受体(transferrin receptor, TfR)。血清来源的 EXO 也表达有丰富的TfR,其可以通过与血液中游离的转铁蛋白(transferrin, Tf)结合,进而靶向大脑,适合用于构建胶质瘤靶向的药物递送系统。
丹参酮ⅡA (tanshinone ⅡA, TanⅡA)在抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制新生血管形成等方面表现出了出色的潜力。但TanIIA难溶于水的性质也限制了其在抗肿瘤方面的应用。甘草酸( glycyrrhizic acid, GL)不仅可以抑制肿瘤细胞生长,还可以与脂溶性成分自组装形成纳米胶束,从而起到增溶作用。利用纳米技术将中药活性成分负载于纳米载体中,可以有效改善溶解度和生物利用度,增强药物的稳定性以及对病灶部位的靶向性。免疫疗法通过调动机体的免疫系统,从而抑制和杀伤肿瘤细胞。含未甲基化的胞嘧啶 - 磷 酸 - 鸟嘌呤基序的寡聚脱氧核苷酸(CpG-Oligodeoxynucleotide, CpG ODN)作为一种新型佐剂,因其强大的免疫刺激作用被广泛关注和研究。但在新一轮的Ⅱ期临床试验中,发现 CpG 无法显著提高手术后 GBM 患者的生存率。
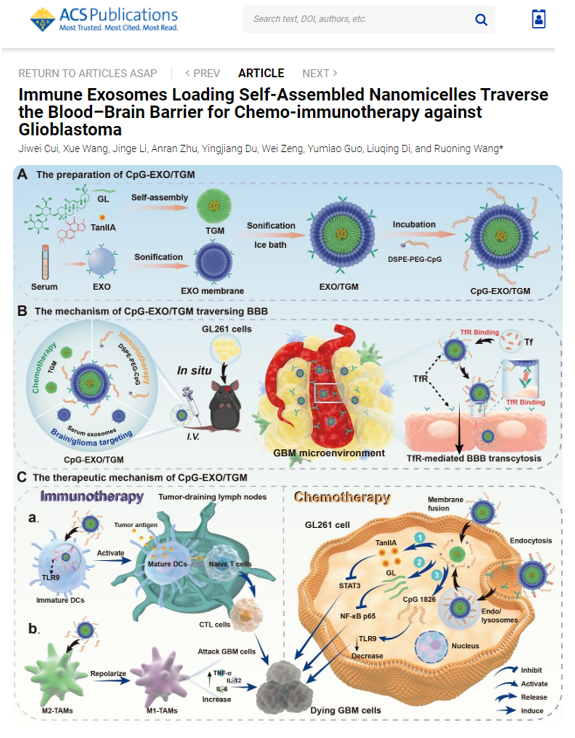
基于此,南京中医药大学王若宁/狄留庆团队研究设计了使用TanⅡA和GL自组装形成的纳米胶束(TanⅡA-GL nano-micelles, TGM),并在EXO表面修饰了免疫佐剂CpG ODN 1826,构建了一种脑胶质瘤靶向及化疗、免疫治疗一体化的仿生纳米递送系统,命名为CpG-EXO/TGM(如图1所示)。相关研究工作"Immune Exosomes Loading Self-Assembled Nanomicelles Traverse the Blood−Brain Barrier for Chemo-immunotherapy against Glioblastoma》近日发表于ACS Nano ( doi: 10.1021/acsnano.2c10219)。
图1. CpG-EXO/TGM的构建及脑胶质瘤治疗机理
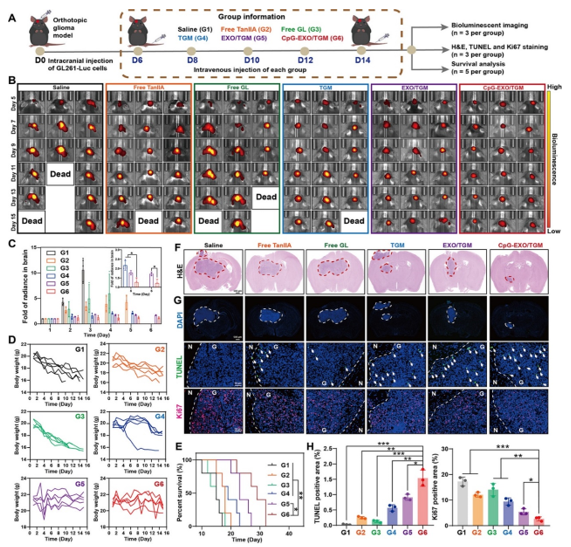
研究结果显示在给药周期中,生理盐水和游离药物组陆续有小鼠死亡,而 EXO/TGM 及 CpG-EXO/TGM 组的小鼠在给药周期中没有死亡。此外,通过对小鼠脑部生物荧光进行半定量 ROI 分析,也可证明 CpG-EXO/TGM 组荧光强度变化最弱,证明EXO包覆后的CpG-EXO/TGM能够显著抑制胶质瘤的生长。此外,EXO/TGM 及 CpG-EXO/TGM 组没有观察到明显的体重变化,证实它们在确保治疗效果的同时无明显毒副作用(如图2所示)。
图2. CpG-EXO/TGM体内抗脑胶质瘤作用评价
该研究利用中药活性成分自组装纳米胶束、富含特异性蛋白的外泌体和磷脂修饰的免疫佐剂,通过超声破碎和孵育的方法制备所得荷载中药自组装胶束的“免疫外泌体” 纳米粒,可以有效改善单一载体药物荷载量低、生物相容性差、靶向穿透力弱、治疗机制单一等问题,能够精准靶向脑胶质瘤病灶部位,通过化学疗法和免疫疗法协同治疗脑胶质瘤,在未来具有广阔的应用前景。
参考文献:
Immune Exosomes Loading Self-Assembled Nanomicelles Traverse the Blood-Brain Barrier for Chemo-immunotherapy against Glioblastoma, ACS Nano. 2023 Jan 10. doi: 10.1021/acsnano.2c10219.
外泌体资讯网 ACS nano | 南京中医药大学王若宁/狄留庆团队:“免疫外泌体”荷载中药多组分自组装胶束多模式协同治疗脑胶质瘤