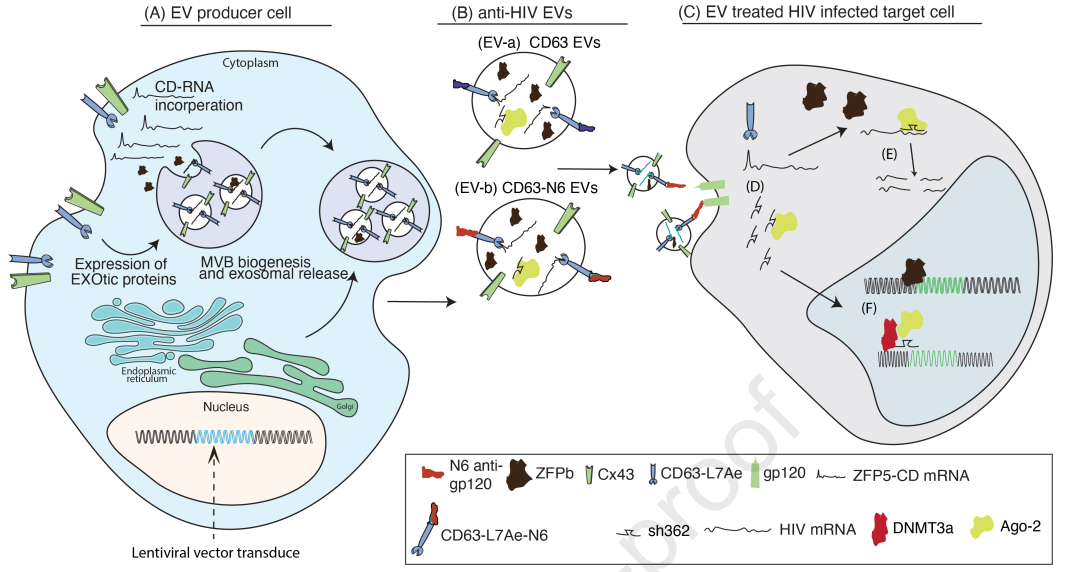
细胞外囊泡(EV)被认为是用于各种基因治疗的有前途的运载工具。它们是相对惰性的、非免疫原性的、可生物降解的和生物相容的。至少在啮齿动物中,它们甚至可以通过具有挑战性的身体障碍,例如血脑屏障。EV可以设计为携带和递送治疗分子,如蛋白质和RNA。因此,EV正在成为一种体内基因治疗载体。近日,Mol Ther杂志上发表一篇文章,对EV作为递送载体的应用进行了概览。我们需要更深入地了解基本的EV生物学——包括细胞生产、EV加载、全身分布和细胞递送——以有效利用这些内源性细胞纳米粒子作为下一代纳米递送工具。然而,即使是完美的EV产品也很难在临床规模上生产。在这方面,作者建议可以使用载体转导技术将细胞离体或直接体内转化为EV工厂,以稳定、安全地调节基因表达和功能。作者从当前的EV最先进技术推断出一个光明的潜在未来,即使用EV治疗当前疗法难以治疗的遗传疾病。
EV生物发生和治疗递送潜力
所有真核细胞都会释放大量的细胞外囊泡(EV):膜结合的纳米颗粒,大致呈球形,直径范围在50至500 nm左右。EV多种多样,不仅按大小分类,还按起源细胞、释放模式、分子组成和功能分类。EV被认为在以下方面发挥作用通过在细胞之间传递核酸、蛋白质、小分子和脂质来进行细胞间通讯,但也可以设想其他相互作用模式。值得注意的是,已观察到这些分子在EV中运输后在受体细胞中保留其功能,这表明含有活性蛋白质、RNA、蛋白质或DNA的EV可以改变远离EV生产细胞的细胞生物学。这些特性赋予EV无与伦比的安全性和生物相容性潜力。迄今为止,一些治疗性生物分子已被装载到EV中并递送至靶细胞,并在体外和体内模型进行了实验验证。
将治疗性RNA加载到EV中
RNA疗法与锌指或CRISPR疗法相比具有明显的优势,因为RNA通过内源性细胞通路以瞬时方式发挥作用并且是可编程的,因此相对容易针对特定疾病进行工程改造,并且通常不具有免疫原性。已经发现和研究了具有生物学功能和治疗潜力的各种RNA生物型,例如小干扰RNA(siRNA),从而导致了新型治疗药物的开发。RNA可用于赋予短期瞬态和长期表观遗传沉默,这是基于目标,例如,靶向基因启动子可以诱导转录基因沉默。值得注意的是,基于mRNA的疫苗现在也被有效地用于对抗COVID-19大流行。然而,尽管治疗性RNA可以快速改变和产生,但它们必须达到预期目标才能有效。例如,Pfizer-BioNTech COVID-19疫苗中使用了脂质纳米颗粒(LNP)并用于治疗针对肝脏的多发性神经病,但这些方法可能具有细胞毒性,在循环中不稳定,并且不适合输送到其他组织。此外,基于RNA的药物的细胞和亚细胞递送也是一项艰巨的挑战,只有不到1%的有效载荷到达细胞的胞质溶胶。潜在地,将这些RNA包装到天然携带RNA的EV中,可能是一种更安全且更具生理针对性的方法。因此,已经进行了多种尝试以将RNA整合到EV中并优化包装和释放效率。
将mRNA包装到EV中
虽然EV正在成为一种有前途的递送系统,但事实证明,将治疗货物有效地装载到EV中具有挑战性。EV可以在生物发生过程中或在使用物理或化学方法分离EV后自然加载。电穿孔已用于将核酸加载到EV中,但是,这会破坏EV膜的内在特性并导致大量EV损失。因此,将mRNA加载到EV中的最常见方法是用编码治疗性mRNA的质粒转染EV生产细胞。由此产生的高浓度细胞质mRNA足以将mRNA包装到EV中,这可能是因为已经发现EV可以功能性地输出大量过剩的细胞成分。
将RNA加载到EV中的另一种方法是生成脂质包被的RNA颗粒,并通过混合诱导的分区将这些颗粒整合到纯化的EV中。正如预期的那样,此过程会导致EV尺寸略有增加和EV数量减少,但它是高效且准确的(>90%)。然而,需要用脂质预包被RNA会带来费用和时间限制以及纯化。因此,虽然此过程可用于研究目的,但要扩展到临床或商业应用可能具有挑战性。
将shRNA、miRNA和circRNA包装到EV中
众所周知,微小RNA(miRNA)会加载到EV中,并在功能上调节其他受体细胞类型中的基因表达。这可能是通过与Argonaut2(AGO2)的直接相互作用实现的,后者已被发现被包装到EVs中。或者,特定的蛋白质,如YBX1与将特定的miRNAs加载到EVs中有关,而其他人则认为可能没有是参与EVs的miRNA募集的特定基序或途径。还有一些人发现似乎没有特定的miRNA包装系统可以将这些RNA加载到EVs中。由于其靶基因范围相对较大,miRNA可以显著改变细胞的表型或基因表达,因此它们可能是一种具有促进、触发或治疗疾病潜力的高价值货物。
正如EV加载的miRNA通讯通路的存在所证明的那样,相对于其他RNA类型,miRNA似乎优先加载到EV中,这表明细胞内存在内源加载系统。AGO2是一种RNA结合蛋白,可结合miRNA,可能负责EVs中的miRNA加载。由于它们在EV中具有深远的调节潜力和天然存在性,miRNA和AGO2结合小发夹RNA(shRNA)似乎是EV治疗的理想候选者。在EV中观察到的另一类调节RNA是环状RNA(circRNA)。CircRNA是一类单链环状非编码RNA,由mRNA中外显子的反向剪接产生。已观察到一些基因表达的circRNA数量是蛋白质编码mRNA的数倍,表明其具有重要的功能作用,包括通过吸收miRNA进行转录调节、与蛋白质相互作用、与pre-mRNA剪接竞争,以及很少作为模板用于蛋白质翻译。缺少5'和3'末端可保护circRNA免于被核酸外切酶降解,这最终使这些转录本在细胞质中的寿命比其他RNA更长。最近,发现功能性circRNA被EV加载并转移到受体细胞中。EV中的circRNA和线性RNA之间的比率高于生产细胞,表明内源性分选机制。由于它们增加的稳定性,circRNA可以被包装到EV中并转移到靶细胞,在那里它们可以比典型的mRNA更长时间地支持蛋白质翻译。值得注意的是,circRNA可以设计为具有内部核糖体进入位点(IRES)以表达感兴趣的蛋白质。由于circRNA比线性RNA持续时间更长,这可能是产生增强的长期蛋白质表达的一种方法。这种应用在疫苗治疗中特别有用,可以延长抗原对免疫系统的暴露时间,或者通常可以在治疗剂量之外产生最多的蛋白质。虽然天然存在的具有ORF的circRNA在细胞中是少数,并且尚未被证明能够翻译,但已经尝试设计具有编码能力的circRNA。
将蛋白质包装到EV中
虽然EXOtic系统允许将编码蛋白质的mRNA包装到EV中,但其他人已经开发出一种将未结合的治疗性蛋白质加载到EV中的方法。CRY2是一种植物蛋白,在暴露于蓝光时会改变构象,而CIBN是CIB1的截短版本,CIB1是一种对处于激发态的CRY2具有亲和力的蛋白质。CIB1附着在EV标记CD9的胞质尾部,而CRY2附着在报告蛋白,例如mCherry和GFP。当生产细胞暴露在蓝光下时,这个名为EXPLOR的系统被证明可以通过与CIB1的可逆结合将cargo-CRY2加载到EV中。基于这个模型,Osteikoetxea等人测试了CRISPR相关核酸内切酶9(Cas9)蛋白是否可以加载到EV中,并将其与其他三种基于暴露于激活刺激物后的异二聚化的类似加载系统进行比较。研究证明,装载CRY2-CIB1导致EV级分中的Cas9浓度最高,达到每个EV超过20个Cas9分子。这项研究的一个值得注意的观察是数据表明,用于蛋白质货物输送的MysPalm工程似乎与工程化四跨膜蛋白标记(如CD9)相比更具优势。这种观察的两个可能原因是:1)结合结构域在与膜蛋白结合时可能无法在ER中正确折叠或2)它可能干扰CD9定位到EV膜中的天然位点。支持这一观点的观察结果表明,连在一起的Cas9活性仅为WTCas9的30-50%,表明这些加载系统降低了基因编辑的功效。这是相关的,因为未来治疗性EV的功效将取决于数量递送至靶细胞的活性治疗性蛋白质。
另一种将蛋白质装载到EV中的高度创新方法涉及使用WW标签修饰货物蛋白,该标签可被Ndfip1识别,Ndfip1是一种含有L结构域的泛素连接酶,可泛素化货物蛋白,在生物发生过程中将其引入EV41。与CRY2系统不同,附加到Cre的WW标签在执行其功能时与WT蛋白一样有效。WW-Cre在EV介导的递送至受体细胞后发挥功能,并且WW-Cre以依赖于Ndfip1的方式加载到EV中。该方法巧妙地利用了细胞的内源性出芽和蛋白质加载系统,该系统可以扩展以加载治疗性蛋白质进入EV。与CRY2-CIB1加载方法相比,该系统具有一些优势。首先,WW结构域比CRY2蛋白小得多,与人类CRY2的593个残基相比,仅测量了约40个残基。可以说,较大的结合蛋白会带来更高的干扰货物蛋白功能的风险,从而限制治疗效果。
最后,WW结构域天然存在于其他人类蛋白质中,因此与植物来源的CRY2-CIB1相比,可能会降低免疫反应的风险。这两种系统都优于其他蛋白质加载系统,因为蛋白质在EV中是游离的,并直接递送到靶细胞的细胞质中。
制造用于治疗用途的EV
尽管有几项正在进行的临床试验涉及EV,但到目前为止,还没有EV疗法进入市场。部分原因可能在于大规模制造EV的生产和纯化工艺不足,而且大多数当前文献的大部分重点是开发新的EV并通过体外和动物研究证明它们的潜力,很少强调或理解转化EV疗法所需的条件。EV可以设计为携带治疗分子,如蛋白质或RNA,许多研究正在进行以优化其治疗潜力,方法是增加EV的产生和从生产细胞释放,提高货物装载效率,增加组织趋向性,并增加货物释放到目标细胞。EV的生物发生由几种ESCRT蛋白和参与囊泡形成和出芽的蛋白协调,因此,沉默或促进这些蛋白的表达可能会增加生产细胞释放的EV的数量。这可能与提高生产细胞生产EV的效率和降低治疗性EV的制造成本有关。研究人员开发了针对CHMP4C、VPS4B、ALIX和VTA1的shRNA,这四种ESCRT基因参与了EV生物发生。有趣的是,VPS4B和CHMP4C-shRNA、LIX和VTA1 shRNA的组合使释放的EV数量增加了50%以上。
EV疗法的挑战和未来前景
大多数涉及EV的文献都报告了通过100,000g超速离心和通过0.22um过滤器过滤从细胞上清液中提取EV。然后将这些分离的EV用于各种研究,包括体内评估。然而,这种方法很繁琐,会产生异源的EV群体,并且可能难以在临床上转化。此外,体内不到48小时的相对较短的½寿命表明需要多次EV给药作为治疗策略。另一种方法是直接在体内设计细胞,以生产具有明确治疗有效载荷的EV。人们可以设想或许使用隐形慢病毒载体系统或腺病毒在体内转导细胞并将它们转化为治疗性EV生产工厂。或者,可以采用免疫细胞的离体转导,将它们转化为EV生产工厂,类似于目前对嵌合抗原T细胞(CAR)疗法所做的工作。虽然安全性将是一个问题,但这种方法可以回避这个问题困扰当前体外EV系统的制造和批次变化问题。为体内工程细胞增加安全,因为可以通过使用组织特异性启动子、选择疾病特异性治疗性RNA或靶向参与调节特定感兴趣基因的长链非编码RNA来设计EV工厂,这些基因仅针对疾病基因和不是宿主基因。安全性也可以通过使用自杀基因来增强,例如西妥昔单抗(Erbitux),它可以识别并特异性地对表达截短EGFR的细胞进行细胞死亡,并且在临床上常规用于CAR疗法以治疗癌症。最后,也许下一代疗法,例如使用混合整合LNP方法或LNP/腺病毒方法,可能证明可用于将体内肝细胞转化为治疗性EV工厂。无论如何,有一个事实很清楚,EV正在成为一种独特的运载工具,它与LNP和基于载体的系统有很大不同,这无疑将改变基因和细胞治疗的当前轨迹,并为治疗各种疾病开辟光明的未来。问题不是是否,而是何时。
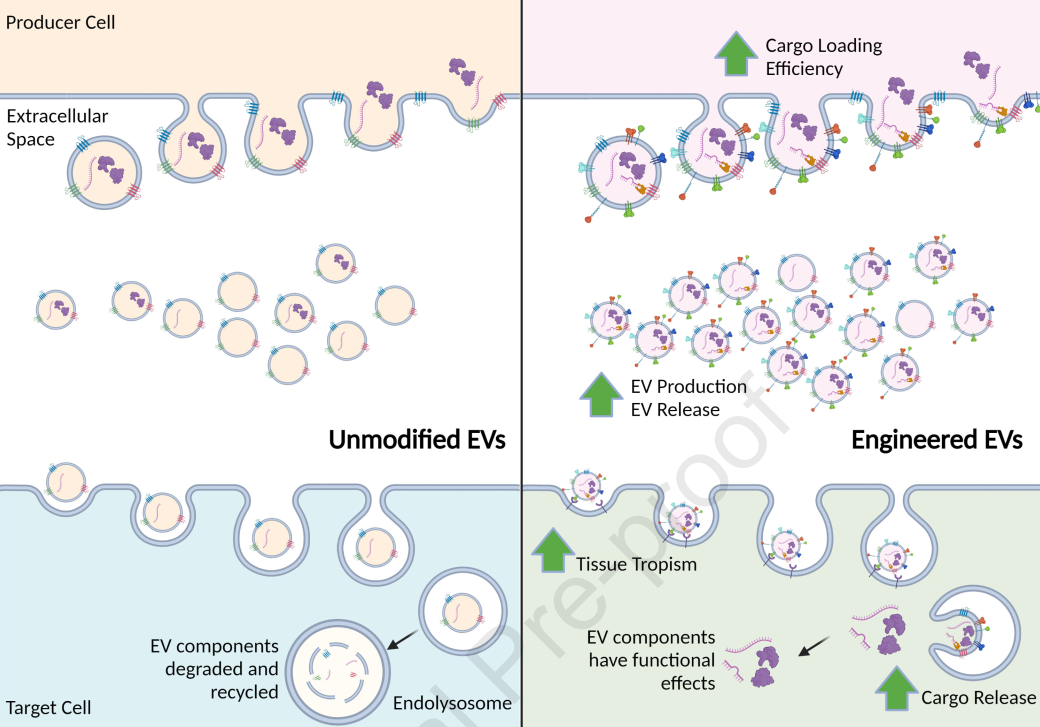
内源性和工程化EV途径
参考文献:
Cecchin R, Troyer Z, Witwer K, Morris KV. Extracellular vesicles: the next generation in gene therapy delivery. Mol Ther. 2023 Jan 24:S1525-0016(23)00021-7. doi: 10.1016/j.ymthe.2023.01.021. Epub ahead of print. PMID: 36698310.