细胞外囊泡(EV)是细胞通讯和生理的重要介质。通过瞬时转染质粒DNA到靶细胞中,可以产生出特定蛋白质或核酸修饰的EV。然而,DNA转染试剂复合物(DTC)的大小与EV大致相同,传统的超离纯化可能无法分离这两种物质,并且DTC产生的活性可能会与EV活性相混淆。来自Codiak BioSciences公司的研究人员发现,差速超速离心(一种常用的EV分离程序)不能将EV与瞬时转染细胞的细胞培养上清液中的DTC分离。因此,一些研究报告的EV活性可能是由于转染试剂的污染,而不是EV介导的货物输送,这表明了对EV样品进行严格纯化和表征的必要性。相关研究以“Transfection reagent artefact likely accounts for some reports of extracellular vesicle function”为题于10月10日在J Extracell Vesicles杂志上发表。
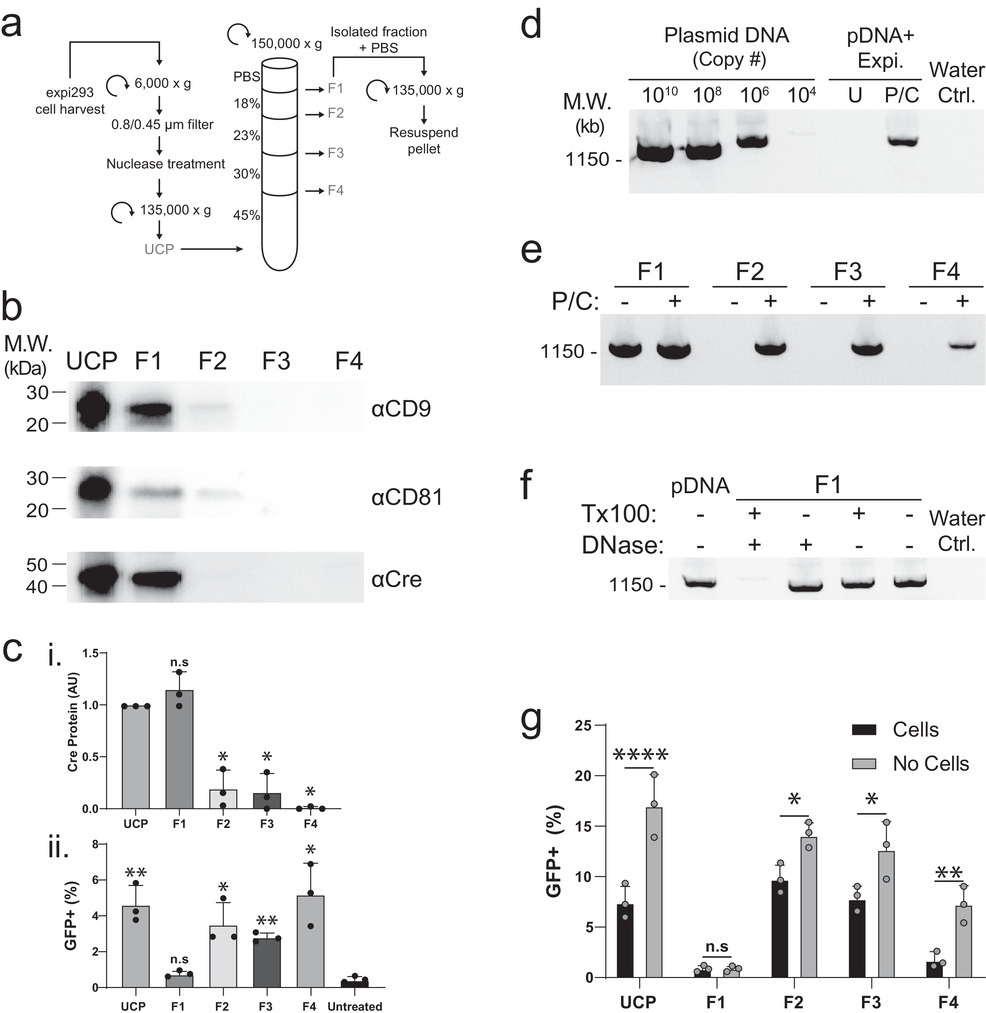
图:Cre转染后细胞分泌的超速离心颗粒(UCP)中存在的Cre活性不全部来源于EV。(A)将从转染了Expifectamine的细胞中分离出的UCP分离为四个组分(F1-4)。(B)用抗Cre抗体和EV标记物CD9和CD81对UCP和密度梯度组分进行Western blot分析。(C)蛋白质印迹密度法定量Cre蛋白(i)。(ii)用50μM氯喹和UCP或F1-4处理3天后,通过流式细胞仪分析GFP+报告细胞的定量。(D-F)琼脂糖凝胶用DNA染料染色,显示样本的PCR扩增。(G)用50μM氯喹和UCP或F1-4处理的GFP+报告细胞的定量。对于无细胞条件,在Cre质粒瞬时转染中没有细胞的情况下,进行模拟转染。细胞外囊泡(EV)是由迄今为止被检测的所有细胞释放,与多种生理和病理过程有关。EV可以通过EV表面分子(蛋白质、聚糖或脂类)与受体细胞表面受体的相互作用,或通过向受体细胞输送货物来介导其对受体细胞的影响。虽然EV货物运输的确切机制尚不清楚,但利用EV自带的天然通信网络对于开发EV疗法具有特别重要的意义。近年来,许多研究已经证明EV能够运送多种货物,包括DNA、RNA和蛋白质。然而,不同研究中的EV传送效率和程度差异很大,可能是由于EV来源、生产方法、分离方法和所用报告系统的不同。特别是,关于EV传递核苷酸能力的报道差异很大,一些报道称EV介导的RNA敲除功能很强大,而另一些报道称没有可识别的功能传递。类似地,报道的蛋白质传递效率范围不确定,从高水平Cre到低水平传递Cre、Cas9和姜黄素都有。在许多情况下,研究报告的EV的作用不大,这可能需要更灵敏的报告系统来检测。然而,这些报告系统的敏感性可能使其容易受到人为因素的影响,重要的是要确保包括适当的控制,以排除非EV来源的物质的干扰。最近有研究报道称,通过装载Cre重组酶的EV用于编辑一个报告细胞系,并且在增强DNA转染试剂复合物的内体途径逃逸药物(如氯喹)的存在下,这种基因编辑活性显著增加。研究人员通过以下相同的程序复制了这一发现:用EV靶向的Cre去转染细胞,然后通过差速超速离心纯化该细胞分泌的EV,并用再重悬的超速离心颗粒(UCP)处理报告细胞。虽然研究人员能够检测到含有EV的UCP样本中的Cre活性,但也观察到Cre蛋白水平与Cre活性水平并不相关,这与之前其他课题组观察到的情况类似。因此研究人员认为,当使用瞬时转染并进行标准的EV纯化时,EV在报告细胞的基因编辑中实际上是可有可无的;相反,Cre活性是由于DNA转染试剂复合物(DTC)与UCP中的EV共同纯化出来而造成的。研究数据证明,EV靶向的Cre重组酶的生物活性是由于质粒DNA的污染,而不是EV介导的Cre蛋白传递。尽管DTC在电荷和密度方面与EV在生物物理学上有所不同,但它们在大小上相似,因此某些纯化方法(如差速超速离心)不太可能分离这两种类型。通常采取的从EV样本中去除质粒DNA的步骤是介质交换和核酸酶处理,但在这种情形下是无效的。由于这些细胞分析中质粒DNA的有害性质,因此一些关于EV功能的研究可能是DTC污染样本产生的功能。EV和DTC可以通过密度梯度超速离心分离,这突出了在使用EV生产时,如果通过瞬时转染来检测EV功能时,一定要确保消除DTC。参考文献: Transfection reagent artefact likely accounts for some reports of extracellular vesicle function. J Extracell Vesicles. 2022;11(10):e12253.