近日,JEV杂志上发表一篇文章,报道开发了一种新颖的非对称深度过滤(depth filtration, DF)方法,用于从生物流体中分离细胞外囊泡(EV),该方法在分离EV的纯度和产量方面优于超速离心和尺寸排阻色谱法。该研究是首次关于非对称DF分离EV的报道。
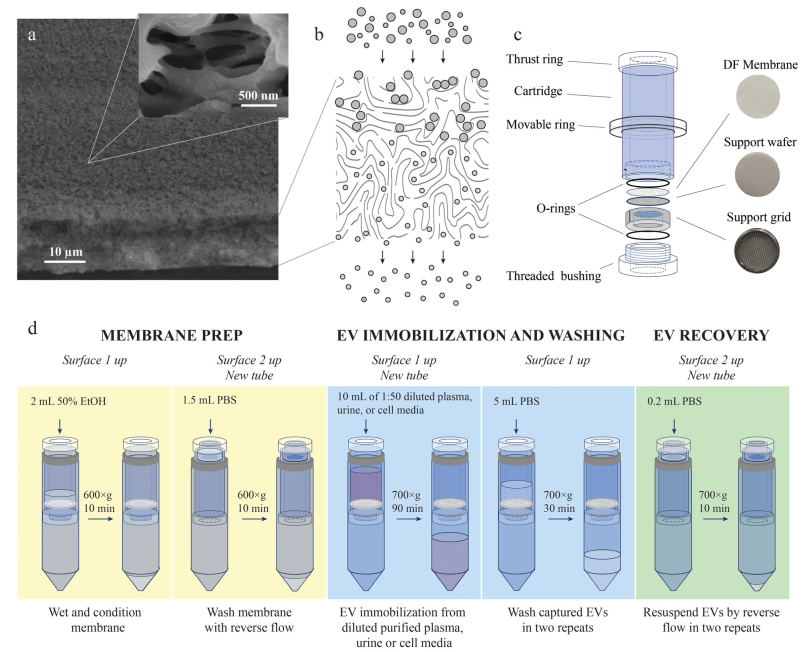
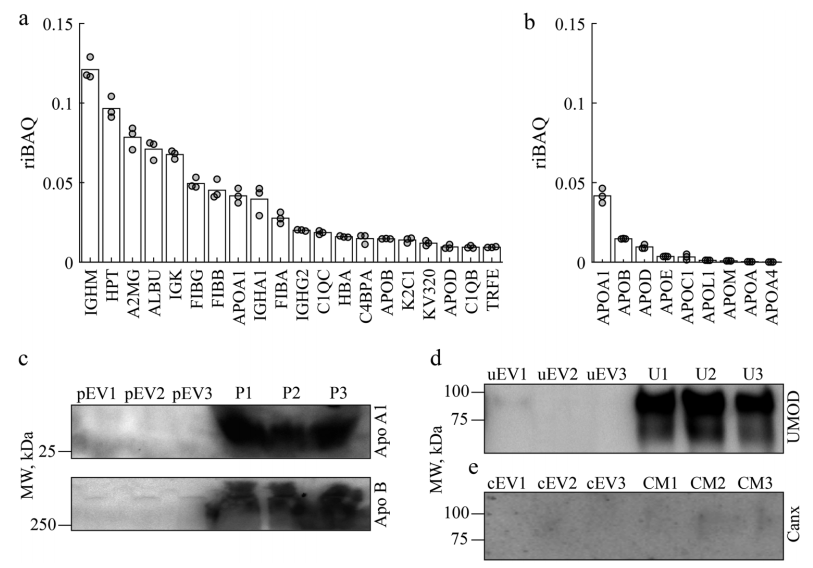
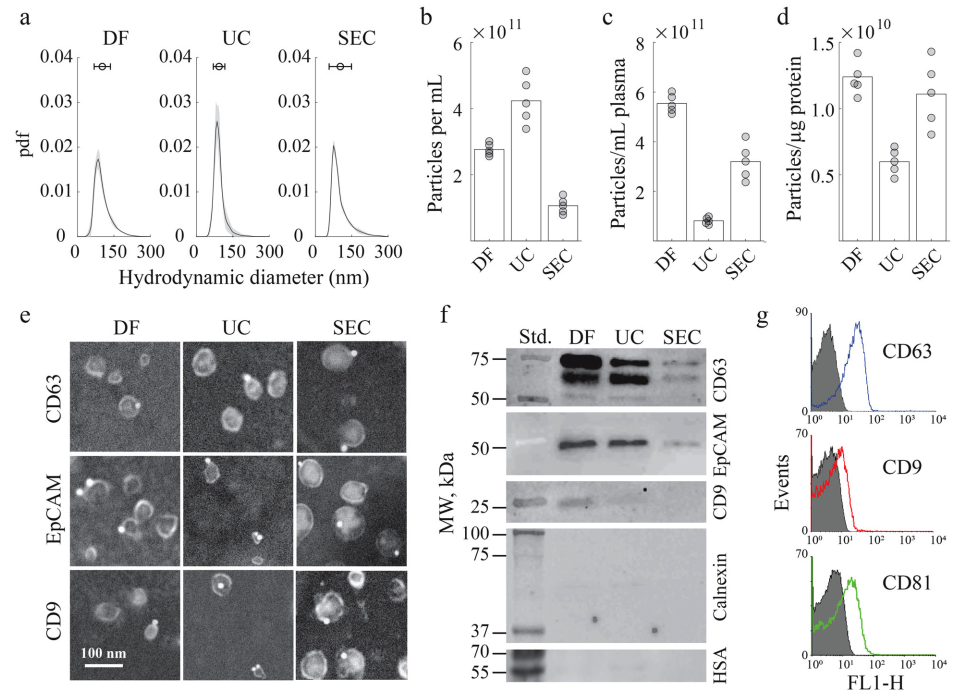
从复杂的生物流体(如血浆、尿液、唾液、羊水和培养细胞的生长培养基)中分离EV具有挑战性。分离的EV经常受到复杂的生物流体生物分子环境的污染,包括在大小和其他生物物理特性上与EV重叠的脂质纳米颗粒和蛋白质聚集体。从这些流体中分离出来的EV的产量因分离方法而异。例如,据报道,每毫升血液分离出107至1013个EV。在血液和血浆中,脂质颗粒的浓度高于EV,即使使用了专门设计用于消除它们的方法,也会对污染造成很大影响。例如,最近开发的精细沉淀-纯化方案将EV分离物中的脂质颗粒减少到令人印象深刻的10%;然而,污染依然严重。溶解蛋白质的污染也同样多变,据报道,每107至1011个EV中含有1微克蛋白质,具体取决于所应用的分离方法。大多数分离方法可以通过它们在生物流体中存在的所有EV的无偏高产分离和分离EV的纯度之间实现的权衡来评估。在一个极端情况下,沉淀技术有效地将所有生物纳米颗粒从生物流体中提取出来,但代价是共沉淀的非EV成分会造成严重污染。另一方面,免疫亲和捕获分离出污染最少的EV,但只拿到了少数表达捕获生物标志物的囊泡亚群。虽然样品的纯度是必不可少的,但有偏差和分馏的分离,即使是纯的,也是有问题的,因为它们可能无法充分代表整个异质EV群体的多因素和多方面的生物活性。其他分离方法——包括超速离心、尺寸排阻色谱、过滤、场流分离和方法的组合——可以通过它们协调最大化EV产量同时最小化交叉污染的艰巨任务的能力进行类似的评估。包含专用纯化程序的多步方法被认为是分离高产率和纯度的EV所必需的。该研究介绍了不对称深度过滤,作为一种新颖的替代方法,使用仅需要在过滤膜上进行反向流动的单步程序来无偏地分离高纯度EV。传统过滤是一种应用广泛的分离技术,一般分为表面过滤和深层过滤。表面过滤过滤过大而无法通过过滤器的颗粒,而溶解的成分和小颗粒则通过孔。当样品沿垂直于过滤器表面的方向流动(正常流动过滤)时,较大的颗粒会积聚在上游表面,形成“滤饼”,最终堵塞孔隙并阻碍进一步过滤。切向流过滤(TFF)通过使样品切向流向过滤器表面来减少滤饼的形成,从而使规模扩大到更高的体积。在切向和正常流动的方法中,表面过滤已在EV制剂的分离、浓缩和纯化中得到应用。例如,从细胞生长培养基中分离EV是可能的,但通过单步表面过滤尚未见成功分离血浆的EV。与表面过滤不同,深层过滤(DF)介质的孔隙太大,颗粒不会完全限制在过滤器表面。相反,粒子通过它们在介质中的流动性差异进行动力学分级。溶解的组分可以自由洗脱,而较小颗粒的运输受到阻碍,但比较大颗粒的运输要少。因此,载流首先洗脱小颗粒。较大的颗粒要么稍后洗脱,要么被困在过滤器的深度内。这种捕获可能是由于孔的曲折几何形状、不对称过滤器中横截面的减小、已经固定的颗粒减小孔的孔径以及与过滤介质的相互作用造成的。过滤器内捕获的颗粒的积累最终会堵塞它。然而,由于整个介质都参与分馏,而不仅仅是其表面,深层过滤器可以在失去其功能之前处理更大量的生物流体。此外,过滤能力可以通过重新悬浮和通过反转流动方向来洗脱捕获的颗粒来完全或部分地再生。可以添加添加剂,例如表面活性剂和酶,以帮助再生。可以优化孔径和几何形状、表面和深度吸附以及动力学参数(例如流速、持续时间和流体粘度)以通过深度过滤有效去除杂质。总的来说,DF是一种适应性强且可扩展的分离方法,具有广泛的应用,包括废水的大容量过滤和生物制造生物制剂的纯化。该研究提出非对称深度过滤作为一种普遍适用的方法,用于高产量分离低污染的EV。所开发的方法将EV固定在多孔介质的表面和深度内,然后通过使载流反向流过过滤器来恢复它们。在一个步骤中,它以高产率和纯度将EV从复杂的生物流体(如血浆)中分离出来。作者提出了机制,并提供了支持它们的实验证据,这解释了通过不对称DF分离EV和污染物去除,导致溶解背景和血浆EV制剂中脂质颗粒数量的减少。研究证明了DF在分离血浆EV(pEV)中的性能与Zhang等人开发的优化的三步分离程序相比具有优势。该研究量化了DF在分离pEV的产率和纯度方面的优势,并与两种已建立且广泛使用的分离方法——超速离心(UC)和尺寸排阻色谱(SEC)进行了直接比较。在当前的实施中,将开发的EV分离方法应用于诊断测试和其他需要少量生物流体的应用,这些应用可以在护理点和资源匮乏的地点进行。通过扩大规模以满足生物制造要求,该方法适用于从用于培养EV分泌生产细胞的大量生长培养基中分离治疗性EV。深度过滤介质和从血浆、尿液和细胞培养基中分离EV的DF方法在分离血浆EV时,单步DF与具有专用纯化程序的多步方法的性能相当,甚至超过多步法。利用尺寸和弹性,生物纳米颗粒在不对称孔中被选择性传输和捕获、与过滤介质的低表面结合以及在通过逆流回收之前清洁过滤器保持的EV的能力,这些都有助于实现纯度和制剂的产量。通过将其从不同的生物流体(血浆、尿液和细胞培养基)中分离出EV,进一步证明了该方法的多功能性。DF工作流程简单、快速且成本低廉。它的实施只需要标准的实验室设备。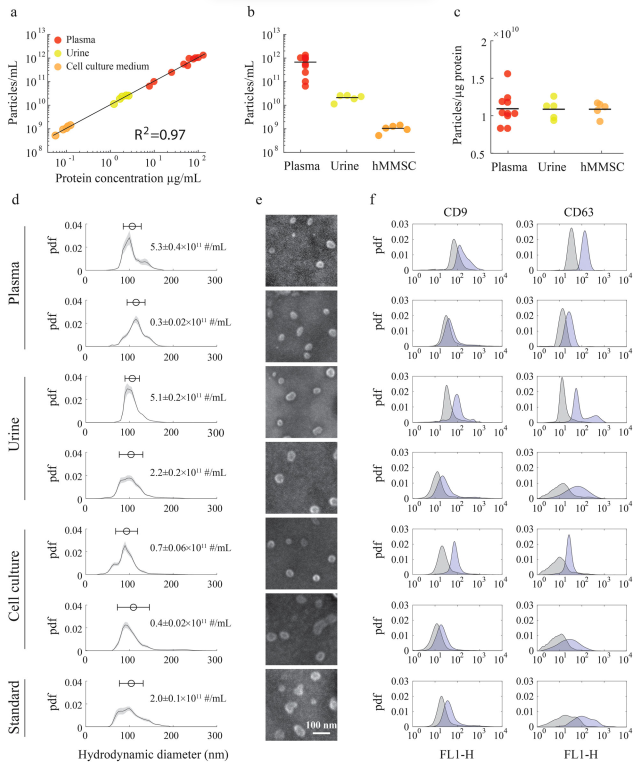
对通过深度过滤从血浆、尿液和细胞培养基中分离的EV进行表征分离先前纯化的血浆EV后DF膜的SEM图像。红色箭头表示孔内和膜表面1上的囊泡Chernyshev VS, Chuprov-Netochin RN, Tsydenzhapova E, Svirshchevskaya EV, Poltavtseva RA, Merdalimova A, Yashchenok A, Keshelava A, Sorokin K, Keshelava V, Sukhikh GT, Gorin D, Leonov S, Skliar M. Asymmetric depth-filtration: A versatile and scalable method for high-yield isolation of extracellular vesicles with low contamination. J Extracell Vesicles. 2022 Aug;11(8):e12256. doi: 10.1002/jev2.12256. PMID: 35942823.外泌体资讯网 JEV:非对称深度过滤,用于高产量分离低污染的细胞外囊泡