由于生活方式的改变和肿瘤的早期发现与治疗,肿瘤患者的预后得到了显著改善,但远处转移仍然是肿瘤相关死亡的主要原因。积极预防和治疗肿瘤转移是提高对恶性肿瘤治疗效果的关键。作为目前肿瘤治疗的主要手段之一,有超过一半的肿瘤患者在治疗过程中应用过放疗。随着放疗技术和相关设备的改进,放疗对恶性肿瘤的治疗效果显著提高,且放疗相关不良反应减少。然而,目前尚未明确放疗是否在肿瘤转移中发挥作用。
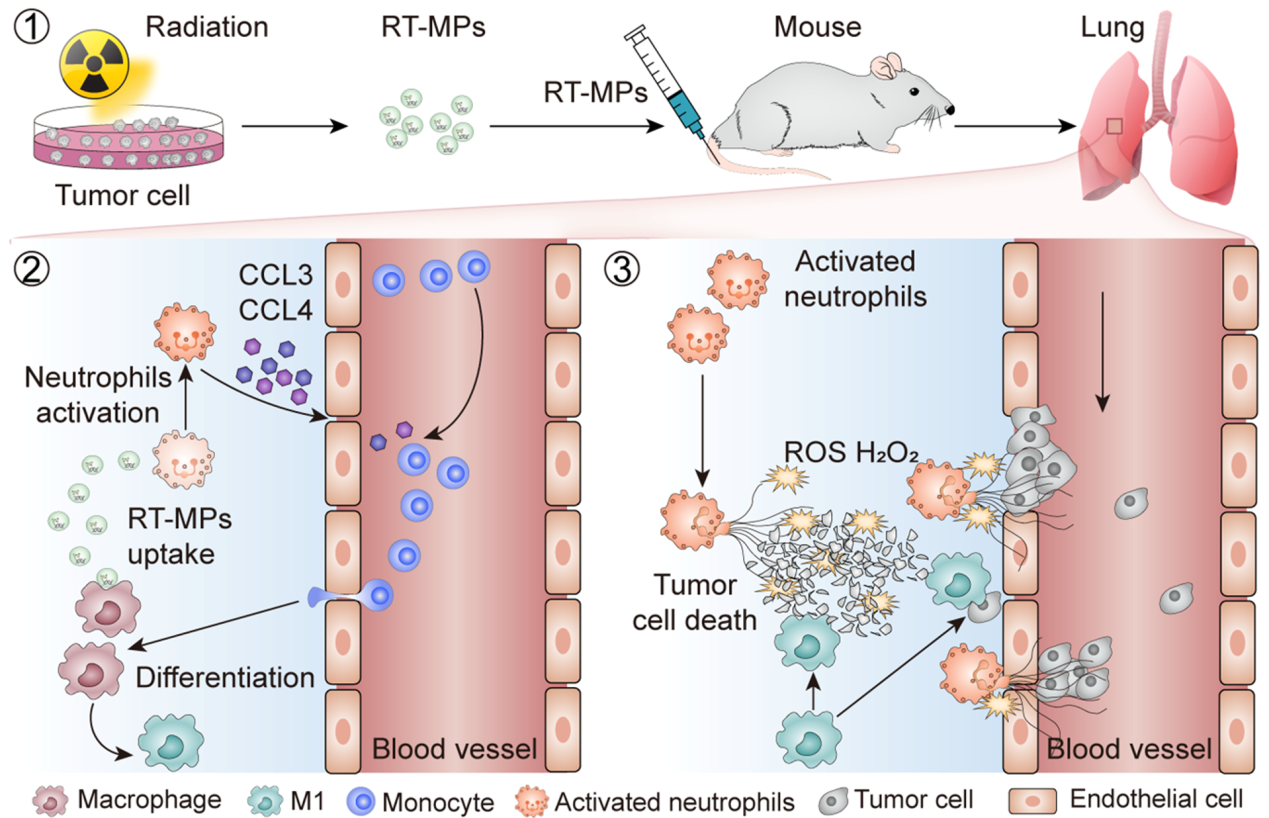
近日,华中科技大学杨坤禹教授和金红林教授联合在放疗领域权威期刊-放疗红皮书——International Journal of Radiation Oncology, Biology, Physics发表了题为“Irradiated Tumor Cell-Derived Microparticles Prevent Lung Metastasis by Remodeling the Pulmonary Immune Microenvironment”的研究论文。(2022 Jul 12;S0360-3016(22)00711-8)。该研究通过建立自发性肺转移模型与实验性肺转移模型,证明了对小鼠皮下移植瘤进行放疗可以使肺转移瘤结节数目显著减少,放疗诱导的肿瘤细胞源微颗粒(RT-MPs)在其中发挥了重要的作用。
机制上,RT-MPs通过中性粒细胞和巨噬细胞依赖性、T细胞非依赖性的方式重塑转移前生态位(PMN)从而抑制肺转移的发生。一方面,RT-MPs可以被中性粒细胞摄取并将中性粒细胞活化,活化的中性粒细胞可以通过释放CCL3和CCL4,从而招募单核细胞到达肺局部,单核细胞可分化为巨噬细胞并在RT-MPs的作用下向M1型极化;另一方面活化的中性粒细胞可以直接释放ROS和H2O2,增强对肿瘤细胞的杀伤作用,从而不利于肿瘤细胞在肺组织的定植并抑制肺转移的发生。该研究证明了RT-MPs可以抑制PMN形成和肺转移的发生,并强调了中性粒细胞和巨噬细胞在PMN形成和抑制肺转移中的作用。
参考文献:Cell-Derived Microparticles Prevent Lung Metastasis by Remodeling the Pulmonary Immune Microenvironment, Int J Radiat Oncol Biol Phys. 2022 Jul 12;S0360-3016(22)00711-8. doi: 10.1016/j.ijrobp.2022.06.092.作者简介:杨坤禹教授,华中科技大学同济医学院附属协和医院肿瘤科主任,博士研究生导师,CSCO鼻咽癌专家委员会副主任委员、CSCO放疗专家委员会常委、CSCO头颈肿瘤专委会常委、中华生物医学工程学会精确放疗技术分会头颈肿瘤专委会副主任委员、湖北省抗癌协会常务理事、国家卫健委“十三五”英文规划教材《Oncology肿瘤学》副主编、国家卫健委“十四五”规划教材《治疗放射治疗学》副主编,主持6项国家自然科学基金、1项国家重点研发计划子课题、1项湖北省重点研发计划,分别于2014年和2016年获得湖北省科技进步二等奖,其中1项为第一完成人,在N Engl J Med、 Lancet Oncol、Sci Adv等杂志发表论文50余篇。金红林教授,华中农业大学生物医学与健康学院教授,博士研究生导师,亚太医学生物免疫学会肿瘤学分会首届委员会委员、湖北省医学生物免疫学学会老年病专委会副主任委员、湖北省医学生物免疫学学会转化医学专委会常务委员、湖北省临床肿瘤学会第一届肿瘤微环境专家委员会常务委员。基金委函评专家和湖北省重点项目评审专家,Journal of Nanobiotechnology和Bioengineering等期刊客座编辑,Chinese Chemical Letters、Frontiers in Bioengineering and Biotechnology和Frontiers in Molecular Biosciences等期刊编委。主持国家自然科学优秀青年基金、2项国家自然科学基金、1项湖北省重点研发计划,在Nano Today、Sci Adv、ACS Nano等杂志发表论文70余篇。
外泌体资讯网 IJROBP | 华中科技大学杨坤禹教授、金红林教授团队:放疗诱导的肿瘤细胞源微颗粒通过重塑肺免疫微环境预防肺转移





