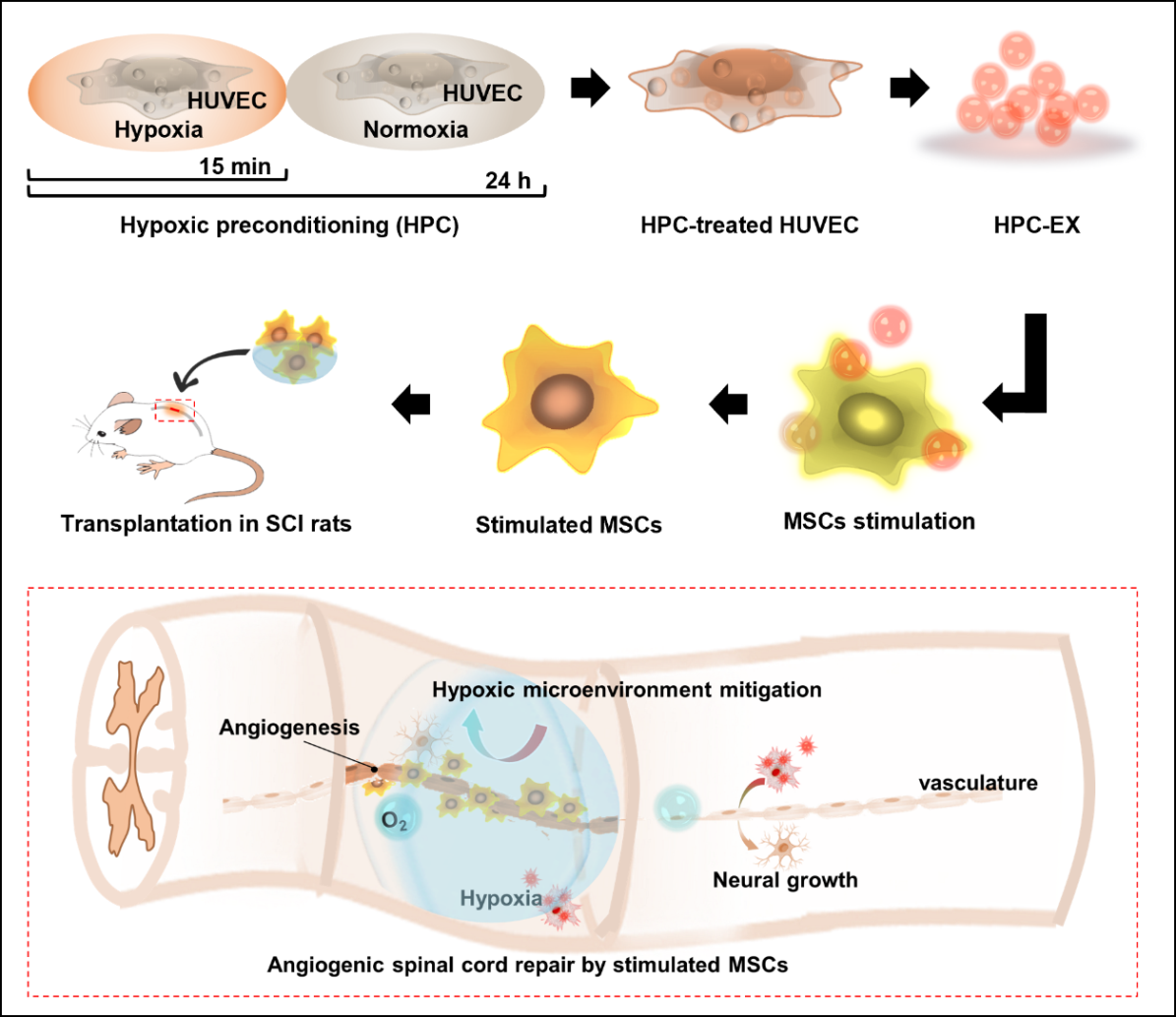
中枢神经组织修复是当今医学的一大难题,脊髓损伤等中枢神经系统疾病目前尚缺少有效的治疗手段,而血管生成是组织修复过程中的重要和首要环节。干细胞疗法在组织修复中显示了良好的前景,其中,多方面的证据显示间充质干细胞(MSC)可通过对微环境中的信息进行响应和反馈从而调节损伤组织微环境并最终促进组织修复。例如,损伤微环境中的血管内皮细胞可促进MSC成血管,将MSC与血管内皮细胞联合移植可增强其组织修复疗效。但实际应用中,血管内皮细胞来源受限,并且,不像MSC具有低免疫原性,血管内皮细胞移植往往可产生免疫排异反应。
近日,浙江大学药学院高建青教授、韩旻副教授共同在ACS Nano杂志在线发表题为“Stimulation by Exosomes from Hypoxia Preconditioned Human Umbilical Vein Endothelial Cells Facilitates Mesenchymal Stem Cells Angiogenic Function for Spinal Cord Repair”的研究论文(doi: 10.1021/acsnano.2c02898),成功利用内皮细胞外泌体调控干细胞成血管并实现脊髓损伤后血管重建和组织修复。该研究论文的第一作者为浙江大学药学院博士后李黎明和博士生母佳富,通讯作者为浙江大学药学院高建青教授和韩旻副教授,研究受到科技部重点研发计划“人脐带间充质干细胞修复脊髓损伤的临床研究”的资助。
研究团队针对脊髓损伤的缺血微环境和成血管修复治疗,基于细胞外泌体在细胞-细胞交流与细胞-微环境交流中的作用,对人脐静脉血管内皮细胞(HUVEC)进行低氧预适应(HPC)刺激并获取其外泌体(HPC-EX),进一步利用该外泌体调控MSC细胞成血管并进行脊髓损伤治疗。在低氧-常氧的HPC刺激中,时长仅15分钟的低氧刺激即可使HUVEC产生有效促进MSC成血管的HPC-EX,摄取HPC-EX的MSC可在2小时内于基质胶中显著成管,并在植入损伤脊髓组织后促进组织中血管生成和改善炎症微环境,有效促进了组织的修复和神经功能恢复。
该项研究为脊髓损伤组织修复治疗提供了高效的促血管生成治疗策略,同时也为基于外泌体和干细胞的研究与疾病治疗提供了新的启发。
参考文献:Stimulation by Exosomes from Hypoxia Preconditioned Human Umbilical Vein Endothelial Cells Facilitates Mesenchymal Stem Cells Angiogenic Function for Spinal Cord Repair, ACS Nano. 2022 Jul 5. doi: 10.1021/acsnano.2c02898.
外泌体资讯网 ACS Nano |浙江大学药学院高建青教授、韩旻副教授团队:低氧预处理的内皮细胞外泌体调控间充质干细胞血管生成实现脊髓修复