血液中分离细胞外囊泡 (EV) 的方法对于将EV作为疾病生物标志物的开发至关重要。血清和血浆都可以使用,但很少有研究比较这些不同血液来源所获得的EV类型是否有所不同。来自瑞典哥德堡大学的研究人员确定了血浆和血清中具有不同的EV亚群,多种四次跨膜蛋白标记物可用于区分不同来源血液的EV类型。该研究发表于J Extracell Vesicles杂志上。
细胞外囊泡 (EVs) 是脂质双层膜的纳米级结构,可以在细胞之间传递生物信号,通过来源细胞转移功能性生物活性分子来调节受体细胞的活动。在EV的生物发生过程中,EV装载有货物分子,包括脂质、RNA 种类和细胞质蛋白以及与EV膜相关的表面受体。
EVs是一类很有前途的新型生物标志物,因为它们存在于血液、尿液和唾液等多种生物体液中,并且能够保护囊泡内分子(如不稳定的RNA)。重要的是,EV货物可以反映其生产细胞的状态,并且可以包含例如癌症进展相关的分子。这些发现引起了人们对利用EV作为不同癌症和炎症性疾病的诊断、预后和治疗反应生物标志物的兴趣。例如,EV相关的 RNA和蛋白质已被建议作为胶质母细胞瘤、恶性黑色素瘤、前列腺癌和哮喘的生物标志物。
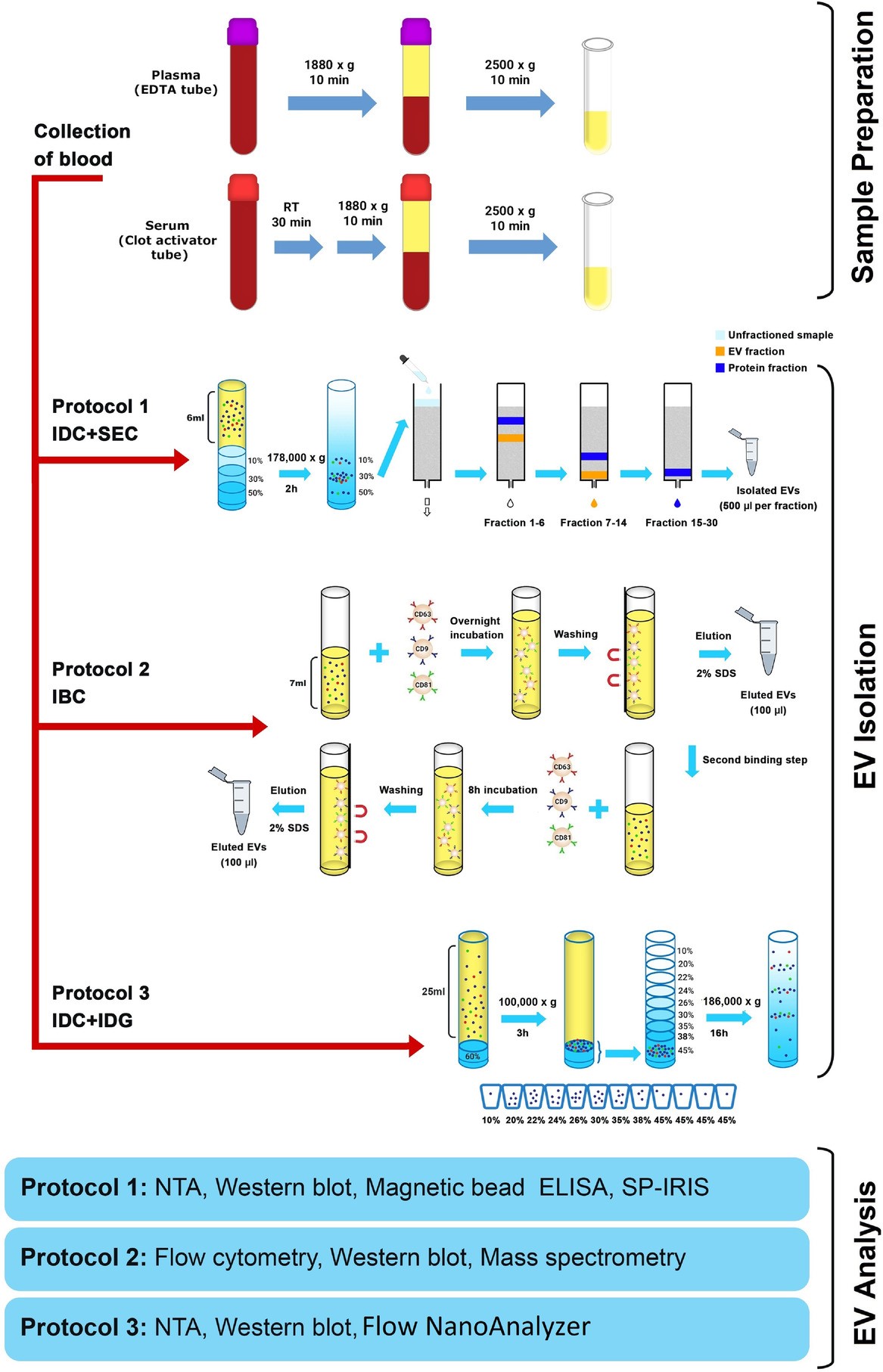
从血液中纯化或富集EV的有效方法对于生物标志物发现研究至关重要。血液是最常规收集的生物流体之一,但血液是分析起来最复杂的生物流体。研究血浆和血清中的EV相关的一些困难和挑战包括:可溶性蛋白质(如白蛋白和纤维蛋白原)的污染以及脂蛋白颗粒与EV的分离。目前,多种技术已被用于从循环的EV分离物中去除最丰富的血浆蛋白和脂蛋白颗粒,并取得了不同程度的成功。该研究团队之前开发了一种新方法,通过使用密度垫和尺寸排阻色谱 (SEC) 相结合,将EV从血浆中分离出来,从而把分离的EV中的脂蛋白颗粒污染降至最低。
血清和血浆都含有EV,并已用于EV生物标志物的发现,尽管血浆更常用一些。血浆和血清成分相似;然而,由于血清中去除了纤维蛋白凝块,血清中的细胞含量以及可溶性蛋白质(例如纤维蛋白原)都比较少。EV领域已经讨论过血浆或血清是否均可以推荐用于EV生物标志物研究。大多数情况下,血浆被认为优于血清,因为人们担心离体的凝血过程可能导致活化的血小板产生更多的EV,或者可能导致血液循环EV的消耗。然而,很少有研究系统地比较血浆和血清EVs的实际数量和存在的和可以分离的EVs的表型。因此,本研究的目的是比较血浆和血清中存在的不同EV亚群的表型。
为此,研究人员采集健康受试者血液,平行分离血浆和血清。ACD或EDTA管用于收集血浆,而血清则在凝血激活剂管中获得。利用密度缓冲垫和SEC的组合、密度缓冲和梯度的组合、通过磁珠抗体捕获系统(抗CD63、抗CD9和抗CD81磁珠),研究人员使用三种不同的EV分离程序从健康志愿者收集的配对血清和血浆样本中分离出EV。通过 NTA、Western blot、SP-IRIS、常规和纳米流式细胞术、磁珠ELISA和质谱分析EV的亚群。此外,比较了不同的血浆分离方案,以确定残留血小板在分析中的作用。
结果显示,与ACD血浆和血清相比,EDTA血浆中存在更多的CD9+ EV,并且这些EV上存在的CD41a表明它们是从血小板中释放出来的。此外,血液中只有极少数EV对CD63 和CD81呈双阳性。CD63+ EVs 在血清中富集,而CD81+的囊泡是血浆和血清中最稀有的亚群。此外,EDTA血浆比ACD血浆、血清含有更多的残留血小板,两种离心方法对于在 EV分离提取之前减少血浆中的血小板数量至关重要。
这些结果表明,人类血液中含有多种携带不同四次跨膜蛋白的EV亚群。血液采样方法,包括使用抗凝剂和选择离心方案,会影响EV分析,因此EV相关研究应该始终详细报告其操作方法。
外泌体资讯网 JEV丨人血清和血浆中具有不同的细胞外囊泡亚群