心肌梗死是世界范围内致残和致死的主要疾病之一,目前的治疗方式主要是尽早恢复心肌的血液灌注,然而对心肌梗死后期导致的心力衰竭仍无有效的防治措施。近来研究表明免疫反应在心脏愈合中起着不可或缺的关键作用,但心肌梗死后不平衡的免疫反应会加重组织损伤,从而诱发心力衰竭(HF)。大量研究证实间充质干细胞来源的外泌体具有广泛的免疫调节功能,但由于其半衰期短,靶向性差等缺点导致心脏部位的外泌体分布严重不足。因此,提高外泌体的靶向性对于其在心脏修复中的应用具有重要临床意义。
近日,复旦大学附属中山医院心内科葛均波/钱菊英团队和复旦大学药学院庞志清团队在Biomaterials上发表了题为 “TargetedImmunomodulation Therapy for Cardiac Repair by Platelet Membrane EngineeringExtracellular Vesicles via Hitching Peripheral Monocytes”的文章(2022, 284: 121529),成功构建血小板膜修饰的细胞外囊泡,通过劫持体内单核细胞实现心脏修复的目的。复旦大学附属中山医院博士生李琦玉为该论文第一作者。
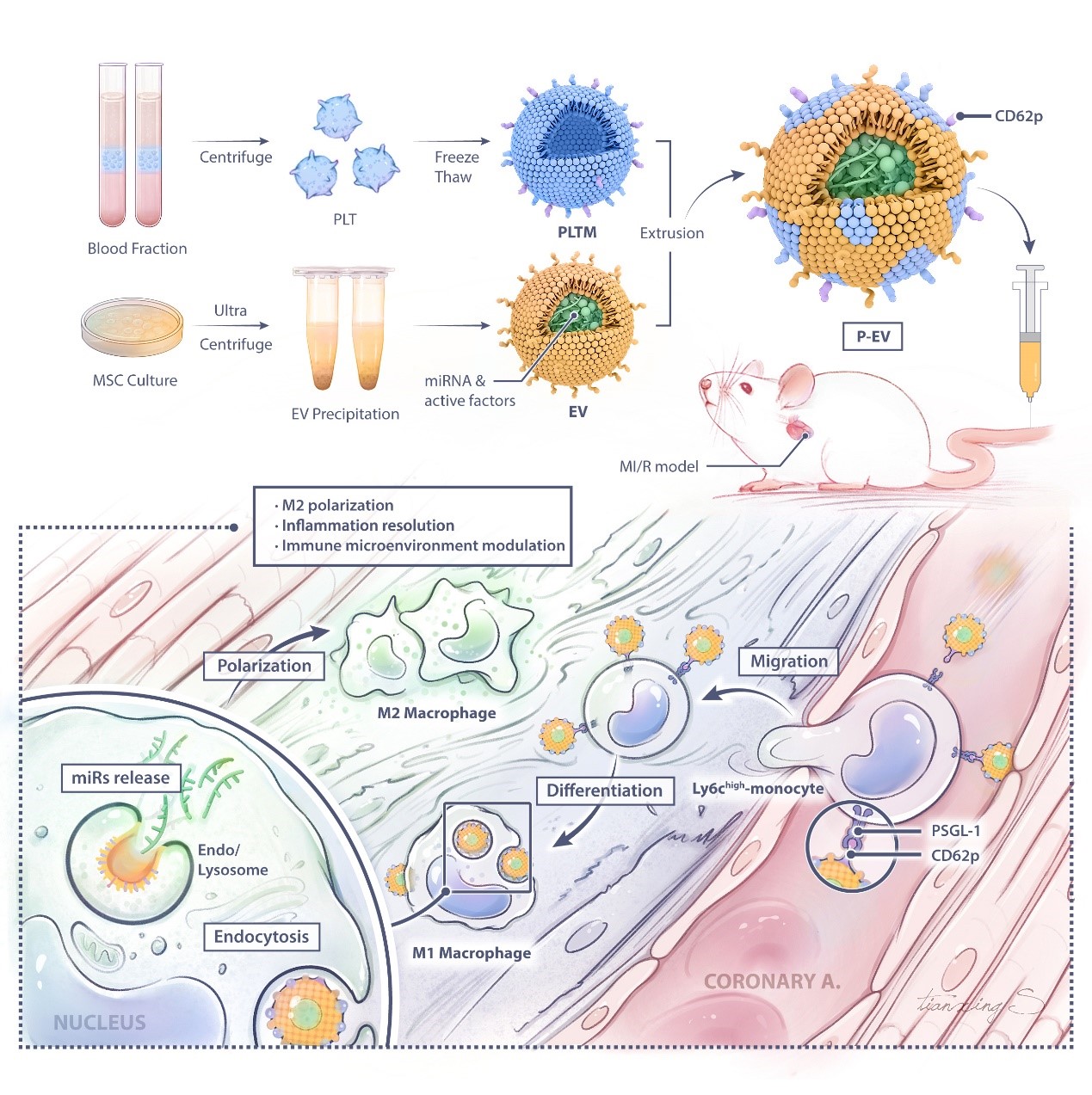
据共同通讯作者之一的宋亚楠副研究员介绍,为实现高效递送细胞外囊泡到受损心肌的目的,该团队提出一种靶向机制:血小板膜修饰间充质干细胞的细胞外囊泡(P-EV),劫持循环中的单核细胞,单核细胞继而介导P-EV到缺血心肌处,从而实现靶向递送P-EV到炎症巨噬细胞。首先,血小板膜表面的糖蛋白赋予了P-EV优先结合循环单核细胞的能力,并随着Ly6Chigh单核细胞募集到心肌缺血交界区。单核细胞跨越血管内皮后受到心脏局部微环境的刺激分化成巨噬细胞,其吞噬能力明显增强,可以大量吞噬原本锚定在单核细胞表面的P-EV。随后,P-EV由于继承了EV逃逸溶酶体的能力,与溶酶体发生膜融合将microRNA等活性物质释放到胞浆中,从而将M1巨噬细胞极化成M2巨噬细胞,发挥免疫调节的作用。该实验结果表明,P-EV在体内外均具有大量结合到单核细胞表面的能力,且与缺血心肌中的巨噬细胞有明显的共定位效果,并且吞噬了P-EV的巨噬细胞多来源于循环中的单核细胞。此外,体内外功能学评价和心超结果均证实,P-EV能够有效极化巨噬细胞,促进免疫调节,改善心功能,实现心脏修复。
该研究提出一种通过劫持体内单核细胞,实现靶向递送P-EV并调节巨噬细胞的新策略,这将为心脏缺血再灌注损伤及免疫相关性疾病的治疗提供一种新的思路。该研究团队指出,虽然血小板膜修饰提高了EV靶向受损心肌处巨噬细胞的能力,但P-EV的靶向性仍受限于体内复杂的生理环境,其后续将致力于研发具有临床传化价值的细胞外囊泡递送策略。
参考文献:
TargetedImmunomodulation Therapy for Cardiac Repair by Platelet Membrane EngineeringExtracellular Vesicles via Hitching Peripheral Monocytes. Biomaterials. 2022, 284, 121529.doi: 10.1016/j.biomaterials.2022.121529.