miRNA已被证明可以补充或增强放疗和化疗疗效,并成为肿瘤治疗的研究热点。然而,靶向性差和基因抑制效率低是导致miRNA治疗效果不理想的两个重要问题,亟需解决。对于前者,靶向纳米载体和智能刺激反应释放是目前最有希望的两种选择;而对于后者,多种miRNA或miRNA与其他药物的联合使用是常见策略。尽管如此,相关领域的研究仍然有限,操作简便且综合效果好的策略仍然稀缺。
2022年4月14日,上海大学生命科学学院陈桂芳教授团队在Nanoscale杂志上在线发表了题为“Smartly responsive DNA-miRNA hybridspackaged in exosomes for synergistic enhancement of cancer cell apoptosis”的研究论文 (2022,doi: 10.1039/d1nr08539e),该团队提出了一种miRNA响应型的药物递送系统,它可以智能响应内源性miRNA,释放出外源性miRNA,从而实现miRNA药物的智能递送。上海大学生命科学学院2019级硕士研究生张帆为该论文的第一作者,陈桂芳教授与青年教师冯畅为论文的共同通讯作者,该项工作得到了国家自然科学基金和上海市浦江人才计划的资助。

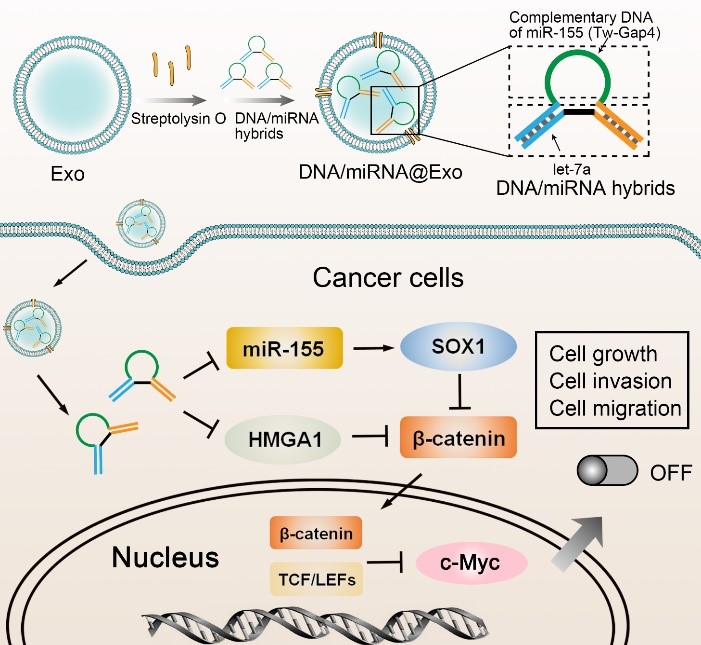
该团队构建的DNA-miRNA组装体由miR-155的互补DNA和let-7a组成,将其包装在外泌体中,递送至细胞内。DNA-miRNA组装体能够响应并抑制乳腺癌细胞中miR-155的过量表达,同时智能释放活性let-7a以进行双靶向的基因调控(如图1所示)。
图1基于外泌体的DNA-miRNA组装体用于核酸药物递送的原理图
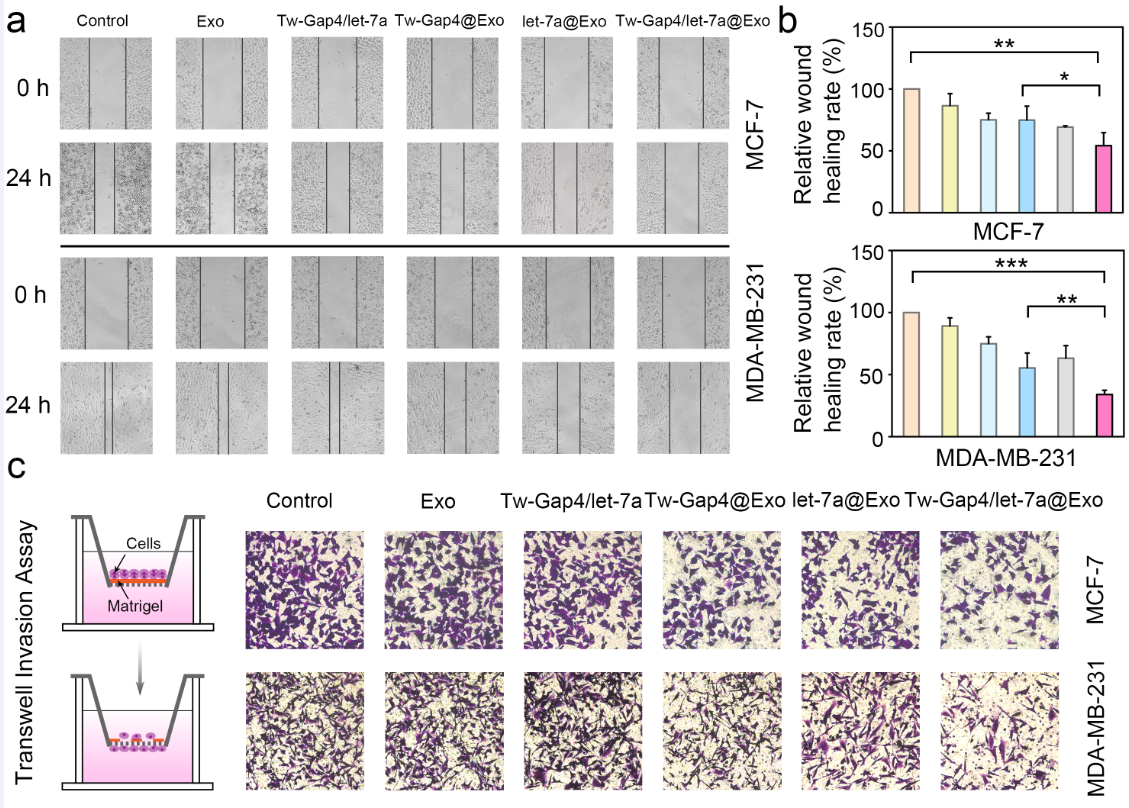
实验结果表明:(1)被外泌体包裹的DNA-miRNA组装体可以被递送进入癌细胞,以响应和抑制内源性miR-155的表达,并同时释放let-7a;(2)通过上调SOX1,下调HMGA1和共同抑制Wnt/β-catenin信号通路,响应型DNA-miRNA组装体可以抑制细胞活力,诱导细胞凋亡,抑制细胞迁移和侵袭;(3)由于其响应能力,DNA-miRNA组装体只对癌细胞起抑制作用,对正常细胞影响不大,因此该系统具有良好的生物相容性。通过进一步引入靶向元素,该系统有望用于miRNA药物的开发和实体肿瘤的治疗。
参考文献:
Smartlyresponsive DNA-miRNA hybrids packaged in exosome for synergistic enhancement ofcancer cell apoptosis. Nanoscale, DOI: 10.1039/d1nr08539e.
外泌体资讯网 Nanoscale | 上海大学生命科学学院陈桂芳教授团队:包装在外泌体中的智能响应性DNA-miRNA杂交体协同增强癌细胞凋亡