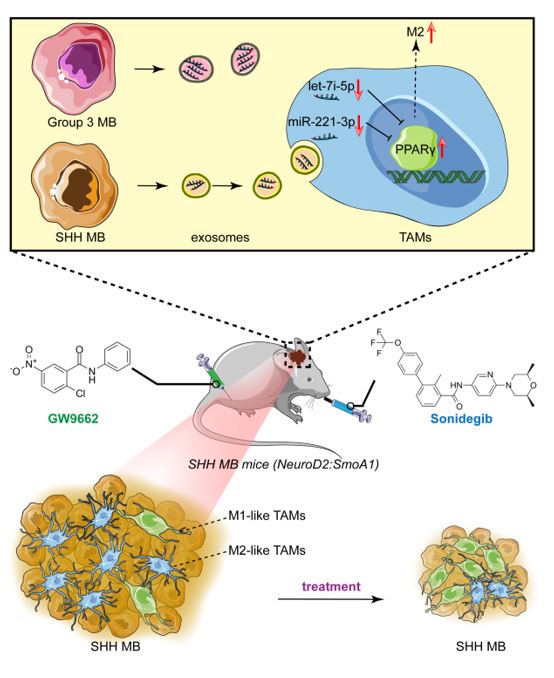
髓母细胞瘤(MB)是儿童最常见的中枢神经系统(CNS)恶性肿瘤,为WHO级4级肿瘤。目前,MB被认为至少包括四个独特的分子亚型,即WNT、SHH、Group 3和Group 4。其中SHH亚群约占所有MB病例的30%,其特征是Sonic hedgehog (SHH)通路的异常激活,该通路在胚胎发育过程中调节小脑颗粒神经元祖细胞(CGNPs)的增殖,并促进肿瘤发生。SMO是一种G蛋白偶联受体,可将SHH信号通过细胞膜向胞内传递。靶向Smoothened (SMO)的抗SHH药物已在临床试验中得到应用。然而,据报道,MB患者中出现的耐药性限制了SMO抑制剂单药治疗的抗肿瘤疗效,因此,亟待开发新的MB治疗策略。近日,北京大学医学部病理系/北医三院病理科常青教授团队在Cancer letters杂志上发表了题为“Exosomal microRNAsinduce tumor-associated macrophages via PPARγ during tumor progression in SHHmedulloblastoma”(2022 Mar15;535:215630)的研究。该研究表明,SHH-MB肿瘤外泌体let-7i-5p和miR-221-3p可以通过调节过氧化物酶体增殖物激活受体γ(PPARγ)诱导肿瘤相关小胶质细胞/巨噬细胞(tumor-associatedmicroglia/macrophages, TAMs)向M2型极化。PPARγ拮抗剂能有效提高SMO抑制剂的抗肿瘤活性,这一作用可能与抑制M2型TAMs的极化相关。研究表明,与其他亚群相比,SHH型MB具有明显不同的免疫微环境,表现出更多的TAMs浸润。然而,TAMs在SHH MB中的确切作用仍是未知。揭示TAM激活/极化的机制及其与肿瘤细胞的相互作用,对发现潜在的降低耐药的免疫治疗靶点至关重要。已有研究显示,MicroRNAs (miRNAs)和其他生物分子可以通过外泌体在肿瘤细胞和TAMs之间递送,外泌体在TAM极化和肿瘤进展中发挥关键作用。该课题组既往研究也表明,MB来源的外泌体miRNA可在肿瘤细胞间转移,影响肿瘤侵袭能力。然而,外泌体miRNAs是否参与SHH-MB进展过程中TAM的极化?为解决这一问题,该团队探讨了MB来源的外泌体miRNAs在肿瘤进展过程中对TAM激活的调控作用。结果发现,这些miRNAs通过调节SHH型MB中的PPARγ,促进巨噬细胞(而不是小胶质细胞)的极化,即向M2表型转化。更重要的是,与单用SMO抑制剂相比,PPARγ拮抗剂(GW9662)和SMO抑制剂(Sonidegib)联合治疗可显著降低SHH-MB小鼠的肿瘤进展。上述结果表明,抑制肿瘤来源外泌体miRNAs靶向的TAM极化途径,可以提高SHH型MB特异性治疗的疗效。 Exosomal microRNAs inducetumor-associated macrophages via PPARγ during tumor progression in SHHmedulloblastoma. Cancer Lett. 2022, 15;535:215630. doi:10.1016/j.canlet.2022.215630.外泌体资讯网 Cancer Lett |北京大学医学部/北医三院常青团队:SHH亚型髓母细胞瘤外泌体miRNA 诱导肿瘤相关巨噬细胞的极化