近的研究结果表明,线粒体可以在细胞之间转移以控制代谢稳态。尽管棕色脂肪细胞的线粒体占细胞体积的很大一部分,并经历重组以维持产热,但仍不清楚棕色脂肪组织(BAT)中是否发生细胞间线粒体转移并调节适应性产热。近日,Cell Metabolism杂志上发表文章,研究证明了产热应激的棕色脂肪细胞会释放含有氧化损伤线粒体部分的细胞外囊泡(EV),以避免产热程序失败。当被棕色脂肪细胞重新摄取时,线粒体衍生的EV会降低过氧化物酶体增殖物激活受体-γ(PPARγ)信号传导和线粒体蛋白(包括UCP1)的水平。通过BAT驻留巨噬细胞的吞噬活性去除线粒体衍生的EV有助于维持BAT生理。体内巨噬细胞的消耗导致BAT中细胞外线粒体囊泡的异常积累,从而削弱了对冷暴露的产热反应。这些发现揭示了组织驻留巨噬细胞在BAT线粒体质量控制中的稳态作用。

棕色脂肪组织(BAT)与冷暴露期间的热量产生有关。冷暴露诱导线粒体代谢和动力学的协调激活,以及氧化应激,这需要BAT介导线粒体质量控制过程,例如选择性降解非功能性线粒体以维持有丝分裂。在其他具有高代谢活性的器官中,例如心脏,也通过线粒体衍生囊泡(MDV)的产生和释放来挤出线粒体成分来实现有丝分裂。该途径由轻度氧化应激的产生诱导,并支持MDV群体的生物发生,这些MDV从线粒体中萌芽并包含一系列特定的货物蛋白。已在多种生理环境中观察到线粒体部分选择性包装成细胞外囊泡(EV),并在线粒体损伤期间被诱导。最近的研究表明,组织驻留巨噬细胞参与主动吸收和清除各种细胞类型释放的细胞外线粒体。然而,这个过程是否发生在BAT中或调节适应性产热仍然未知。最近,研究表明白色脂肪组织(WAT)中的脂肪细胞可以将线粒体转移到巨噬细胞,这一过程可能有助于维持代谢稳态,从而限制WAT扩张和肥胖发病机制。线粒体向巨噬细胞转移受损的小鼠表现出较低的能量消耗,而巨噬细胞耗竭损害了皮下脂肪库中的产热。在心脏中,组织驻留的巨噬细胞耗竭或吞噬能力不足导致细胞外线粒体从组织中的清除缺陷,从而导致组织炎症、异常线粒体的积累和代谢改变。尽管这些观察结果表明线粒体向巨噬细胞的转移调节了组织稳态,但缺乏BAT中这种免疫代谢串扰的证据。这项研究表明,棕色脂肪细胞通过EV释放氧化损伤的线粒体部分,以控制线粒体完整性并保持产热潜力。棕色脂肪细胞衍生的EV在体内被BAT驻留的巨噬细胞吸收。巨噬细胞耗竭诱导线粒体EV的积累,降低线粒体蛋白的表达,并抑制BAT对冷暴露的产热反应。该数据描绘了一个脂肪细胞到免疫细胞物质转移轴,该轴参与线粒体质量控制以保持BAT功能和体内平衡。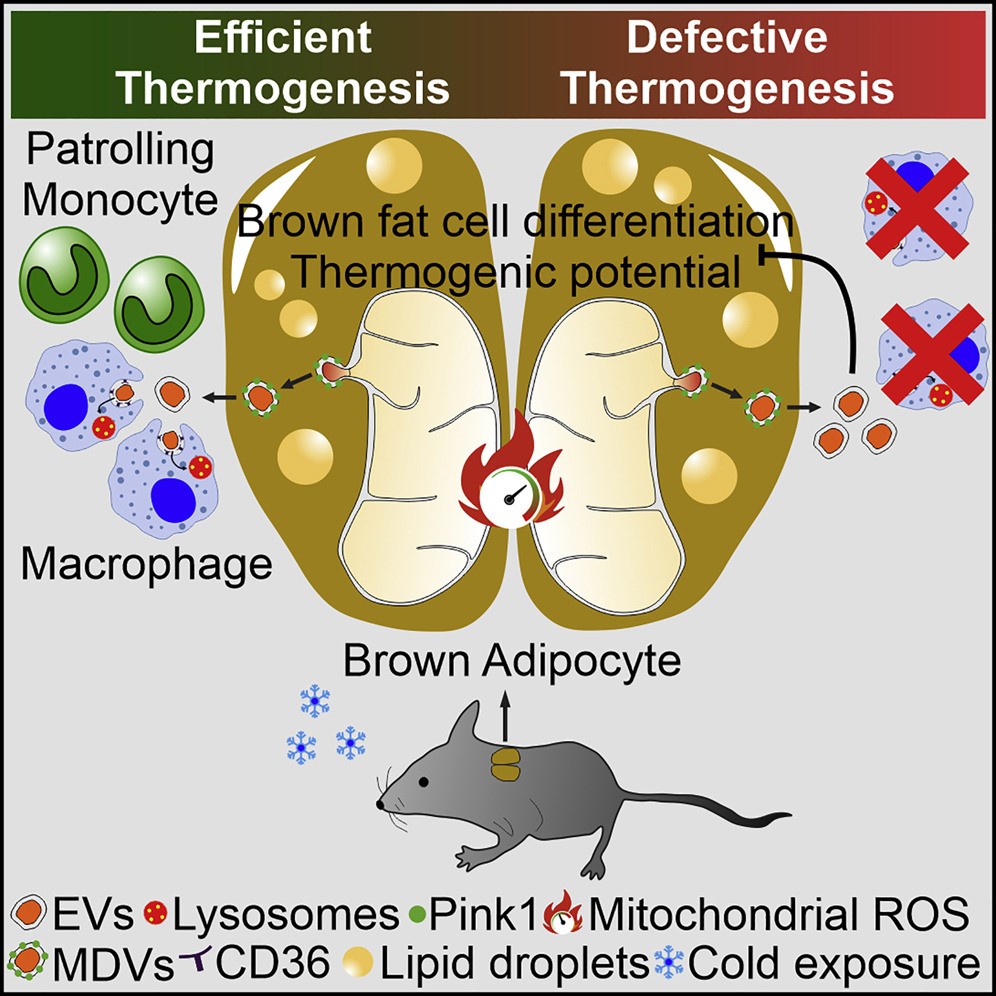
该研究的局限性是棕色脂肪细胞衍生的EV是异质的,有些包含线粒体部分,有些不含线粒体部分。需要更多的研究来确定有或没有线粒体的EV如何差异调节BAT功能。使用骨髓移植和MitoFat小鼠,作者发现BAT驻留的巨噬细胞似乎是BAT中脂肪细胞来源的线粒体的主要受体。然而,这些体内系统无法区分线粒体转移的机制或途径。此外,研究涉及体内巨噬细胞消耗的研究可能通过与清除EV中受损的棕色脂肪细胞线粒体无关的途径影响BAT代谢和功能。缺乏专门破坏含有线粒体的EV释放或捕获的遗传工具,需要开发以了解该过程如何调节BAT功能以及肥胖、2型糖尿病、癌症和衰老中观察到的代谢改变。RosinaM, et al. Ejection of damaged mitochondria and their removal by macrophagesensure efficient thermogenesis in brown adipose tissue. Cell Metab.2022 Mar 15:S1550-4131(22)00088-2. doi: 10.1016/j.cmet.2022.02.016. Epub aheadof print. PMID: 35305295.外泌体资讯网 Cell Metab:棕色脂肪组织通过EVs排出受损线粒体被巨噬细胞清除,从而确保有效产热






