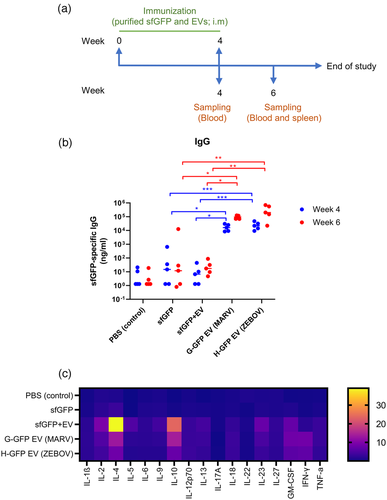
疫苗抗原可以以多种形式呈现,包括细胞内、分泌、膜结合或细胞外囊泡 (EV)。这些抗原表现形式中哪些是否在免疫诱导方面具有优势仍不清楚。来自英国帝国理工学院的研究人员使用GFP作为报告基因和模型抗原,比较了来自一系列病毒糖蛋白的跨膜结构域的EV靶向效率发现,在EV上的病毒跨膜结构域抗原可增强抗原免疫原性。该研究发表于J Extracell Vesicles杂志上。 疫苗接种是防治传染病最有效的方法之一。传统的病毒疫苗属于减毒活或灭活病毒,虽然有效,但通常会引起不良反应。近年来,疫苗研发的重点已转移到开发安全有效的替代疫苗平台,包括基于亚单位蛋白、纳米颗粒和核酸的疫苗平台。虽然新开发的平台总体上可以显著提高安全性,但还存在其他限制,例如低免疫原性。抗原是疫苗中的关键成分,负责诱导抗原特异性免疫反应。设计和优化抗原以提高免疫原性是提高疫苗效力的策略之一。 核酸疫苗平台(例如DNA和RNA疫苗)易于设计和制造,从而缩短开发时间并降低疫苗成本。当通过核酸平台启动疫苗研发时,根据疫苗的设计,抗原可能会在细胞内表达、分泌或在细胞表面表达。或者可以设计用于在细胞外囊泡 (EV) 内部或表面表达。这些不同呈递形式的抗原具有不同的特性,很可能针对和暴露于不同的微环境。例如,分泌型和EV相关形式的抗原可以从生产地点远程传播到免疫诱导位点,而细胞相关形式(细胞内和细胞膜结合抗原)只在原地停留。分泌性或EV膜表面抗原比细胞内或EV内抗原更容易被B细胞和其他抗原呈递细胞(APC)识别。由于许多病毒疫苗抗原候选者是三聚体跨膜糖蛋白,细胞和EV 膜结合抗原具备这样的跨膜结构域,能使疫苗抗原更接近天然构象。鉴于以不同形式呈递抗原的潜力,病毒抗原所在位置的免疫原性仍然是研究的重要焦点。EV(例如外泌体)是由几乎所有类型的细胞释放的脂质双层封闭结构。尽管 EV 生物发生的确切机制仍然难以阐明,但众所周知,将“货物”装载到EV上是一个选择性过程。先前的研究表明,几种病毒糖蛋白在EV表面表达。此外,早期的研究表明,水泡性口炎病毒(VSV) G蛋白的跨膜结构域包含EV靶向信号,并且VSVG跨膜融合蛋白会被加载到EV表面。是否可以通过其他跨膜病毒糖蛋白实现EV靶向性,以及不同跨膜蛋白的EV靶向效率是否会有所不同,还有待研究。 在这项研究中,研究人员使用GFP作为模型抗原,首先比较了各种病毒糖蛋白的跨膜结构域的EV装载效率,然后研究了EV结合的GFP (EV-GFP) 是否会增强免疫诱导。数据显示,与病毒跨膜融合的GFP已成功加载到EV表面。此外,结合GFP的EV主要与外泌体标记物 CD81相关。在小鼠中对EV-GFP质粒产生的免疫原性研究表明,与可溶性和细胞内GFP相比,EV-GFP产生的抗原特异性IgG和IgA显著增加。同样,在用EV-GFP免疫的小鼠中,抗原刺激的脾细胞产生的与GFP特异性T细胞反应相关的细胞因子也得到了增强。用纯化的可溶性GFP和GFP EV进行的免疫原性研究进一步证实了EV-GFP在小鼠中的免疫增强特性。体外摄取测定表明,EV-GFP比可溶性GFP更有效地被小鼠脾细胞摄取,并且这种摄取是B细胞优先的。总之,这些数据表明病毒跨膜蛋白可以有效地将抗原加载到EV表面,并且EV结合抗原增强了体液和细胞介导的抗原特异性反应。 参考文献:Presentation of antigen on extracellular vesicles usingtransmembrane domains from viral glycoproteins for enhanced immunogenicity. JExtracell Vesicles. 2022 Mar;11(3):e12199.外泌体资讯网 JEV丨病毒糖蛋白的跨膜结构域在细胞外囊泡上呈递抗原以增强免疫原性