早期胃癌缺乏特异性症状,大多数病人首次诊治时已经处于局部晚期或者出现远处转移,预后不佳。因此了解胃癌的发展和转移机制至关重要。肿瘤转移是一个循序渐进的过程。转移前生态位是原发肿瘤为后续转移器官创造的有利微环境,遵循著名的“土壤”和“种子”转移理论,也是肿瘤发生转移的关键步骤。细胞外囊泡是癌症转化研究领域一个新兴的热点研究方向。机体所有细胞均可释放细胞外囊泡,大小从微米级到纳米级不等,根据生物发生机制不同分为外泌体和微囊泡。细胞外囊泡携带的“货物”如核酸、脂质和蛋白质可参与细胞间交流,在胃癌的发生发展中扮演着重要的角色。
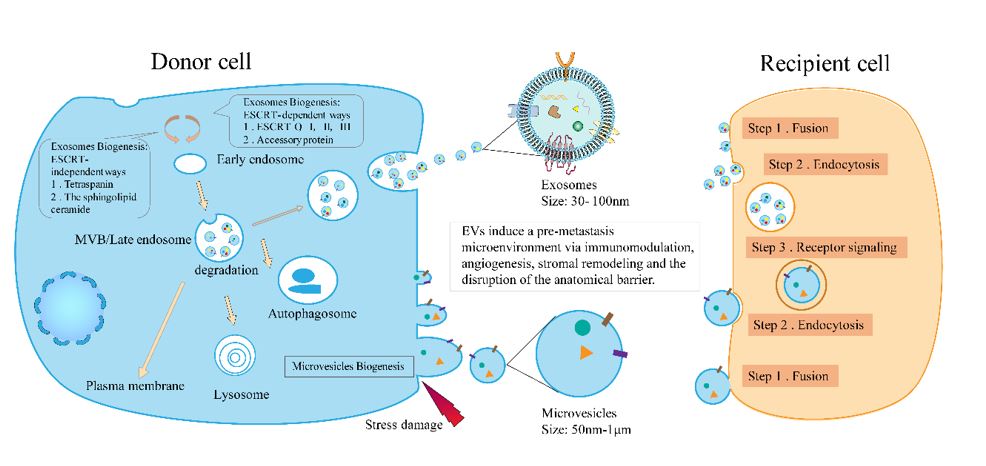
该文首先介绍了细胞外囊泡的发生机制(图 1)。在相对稳定的外部环境下,机体所有细胞均可释放细胞外囊泡。细胞外囊泡是一组异质性群体,根据其生物学来源分为微囊泡和外泌体。外泌体的生物发生、“货物”组装、释放涉及一系列复杂的细胞事件。外泌体是由早期内体向内发芽形成的纳米级囊泡,导致腔内囊泡的产生和富集。它选择性地包含蛋白质、核酸和脂质,用于形成晚期内体即多囊泡体 (MVB),MVB与质膜整合,释放腔内囊泡 (ILV)(即外泌体)。转运所需的内体分选复合物 (ESCRT) 是膜成形和分裂的主要驱动力,也是 MVB 和 ILV 形成的常规机制。ESCRT包含四种不同的蛋白质复合物,ESCRT-0,-I,-II,-III 和辅助蛋白。ESCRT在外泌体生物发生中的最全面研究证明了 23 种 ESCRT 蛋白中有 4 种会影响外泌体分泌,包括HRS、TSG101、STAM1 和 VPS4B 蛋白;有趣的是,当所有ESCRT 复合物的重要亚基同时沉默,ILV 仍然在 MVB 中成型。因此,可以假设外泌体也可以以不依赖 ESCRT 的方式发育,如tetraspanin家族 (CD63、CD81、CD83) 和脂质代谢酶中性鞘磷脂酶。相较于外泌体,微囊泡的生物发生过程更为简单,直接由质膜向外出芽和收缩形成。
图1:细胞外囊泡的生物发生及转移前微环境的形成机制。
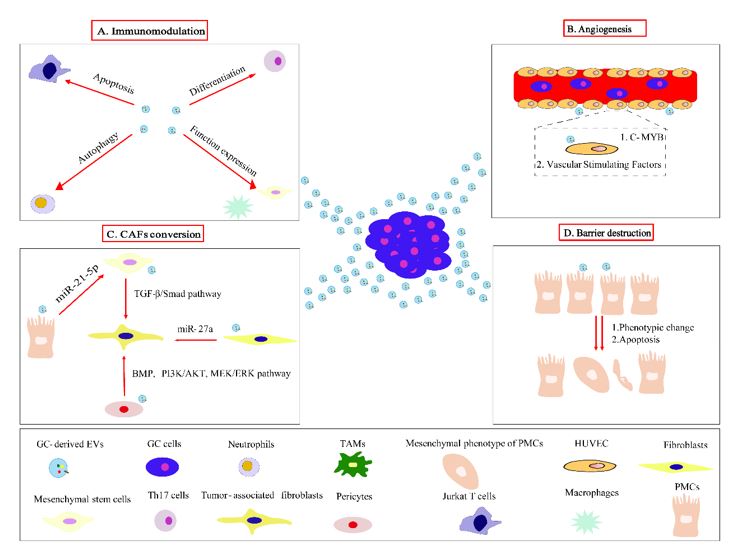
其次总结了胃癌来源的细胞外囊泡携带“货物”如蛋白质和非编码RNA的作用以及在胃癌发生发展中所扮演的角色,以及细胞外囊泡作为胃癌生物标志物的突出优势和潜力。最后文章特别强调胃癌来源的细胞外囊泡充当细胞间通讯介导免疫调节、促进血管生成、基质重塑和亲器官性转移四个过程,最终形成有利于胃癌转移的微环境(图2)。
图2:胃癌来源的细胞外囊泡作用于靶细胞介导转移前生态位的形成
参考文献:
ExtracellularVesicles Promote the Formation of Pre-Metastasis Niche in Gastric Cancer, FrontImmunol. 2022 , 31;13:813015. doi: 10.3389/fimmu.2022.813015.
外泌体资讯网 Front Immunol | 中南大学湘雅医院肿瘤科曾珊教授团队: 细胞外囊泡促进胃癌转移前生态位的形成