细胞外囊泡(EV)的蛋白和核酸已有很多报道进行过研究,但对EVs异质性和功能有重要影响的EV表面聚糖仍缺乏系统研究。近日,京都大学的研究人员在Small Methods杂志(IF 14.188)上发表文章,报道了不同细胞、不同EV亚群的表面聚糖的特征,并对EVs表面聚糖进行修改后发现,不同的聚糖形式会影响EV的细胞摄取和体内生物分布。
细胞间通讯在我们体内不断进行,通过各种方式发送和接收生物信息,包括直接的细胞接触,如配体-受体相互作用,以及间隙连接介导的信号传导,释放生长因子、细胞因子和趋化因子等分子,以及细胞外基于囊泡(EV)的生物活性分子递送。EVs是由脂质双层包围的纳米到微米大小的囊泡,由所有类型的哺乳动物细胞释放,作为一种新型的细胞间通讯工具在各个领域,尤其是疾病的诊断、预后和治疗中引起了人们的关注。
EV生物发生大致可分为三种类型:1)细胞凋亡过程中释放的凋亡小体,2)直接从质膜出芽的脱落囊泡(微囊泡),以及3)称为外泌体的内体衍生的囊泡。有研究使用不对称场流分级方法发现了极小的(≈35nm)非膜颗粒(外泌颗粒)(https://www.exosomemed.com/4061.html)。小型EV(sEV;直径<200nm)通常在差速低速离心后以≥100000g超速离心收集,以去除细胞碎片和大囊泡,但仍然难以根据EV生物发生分离,因为存在一些大小重叠。国际细胞外囊泡协会在2014年和2018年为EV研究开发了用于研究细胞外囊泡的Minimal Information,作者建议使用“EVs”作为这些囊泡的总称,而不是微泡或外泌体,并包括一些信息,如物理特征和生化成分。除了这种复杂性,同一细胞释放不同类型的具有不同成分的小型EVs,这表明即使囊泡大小相似,具有不同功能的EVs也会从同一个细胞中释放出来。尽管已经在EV中鉴定出各种功能分子,包括信使RNA、microRNA(miRNA)和蛋白质,并且已经阐明了它们在癌症转移、炎症反应、免疫调节和伤口愈合中的各种作用,但对EV异质性的研究仍然不足。
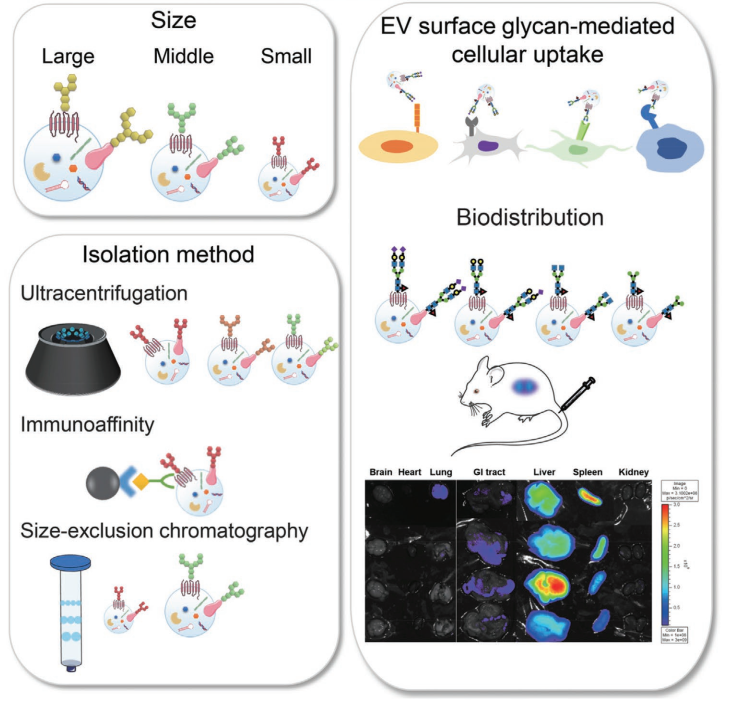
对于EV分离,超速离心是收集几乎所有EV亚型的金标准,密度梯度有时用于分离特定的密度组分。此外,已通过免疫亲和捕获方法和尺寸排阻色谱法分离出EV富含的分子(例如,四跨膜蛋白和脂质)。四跨膜蛋白阴性EVs(直径150-1000nm)表达膜联蛋白A1,通过结构照明显微镜观察到膜联蛋白A1阳性EV出芽,这表明膜联蛋白A1在脱落的囊泡中特异性表达。磷脂酰丝氨酸(PS)富含于EV,可用于免疫亲和方法,这取决于细胞类型、囊泡大小和癌症进展。有研究收集了不同PS含量的sEV,发现它们在密度、尺寸和表面电荷方面存在差异。此外,其他研究表明,EV亚型之间的蛋白质和miRNA谱不同,这表明了解每个EV亚型的功能并标准化其分离方法以用于临床应用非常重要。
尽管如上所述EV亚型的差异已通过EV蛋白、核酸和脂质来表征,该研究将EV表面聚糖作为一种新的EV异质性指标进行了关注。蛋白质和脂质是细胞膜的重要组成部分,它们中的大多数分别以糖蛋白和糖脂的形式存在。聚糖与各种生物和病理过程有关,它们当然在EVs中发挥着重要作用。在过去10年中,人们对EV表面聚糖的兴趣有所增加,例如它们对细胞相互作用和生物分布的影响、作为生物标志物的应用以及用作EV亚群的指标。
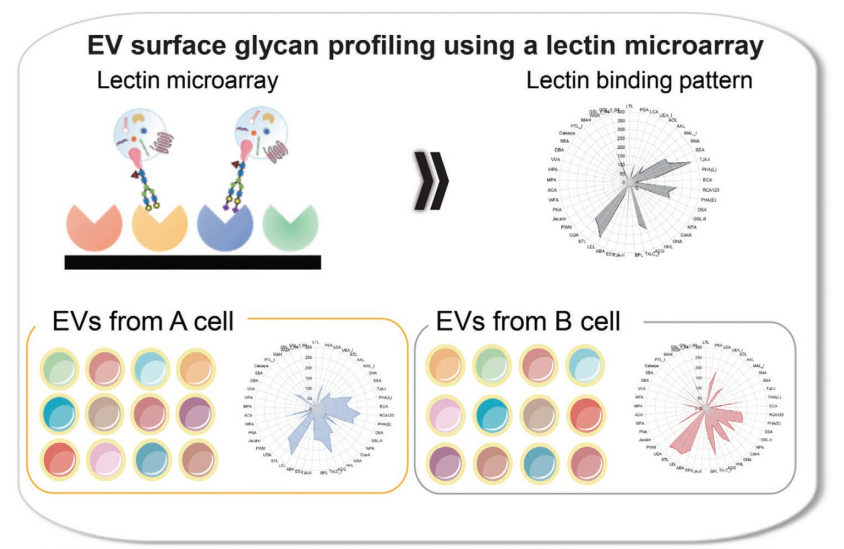
作者之前报道了间充质干细胞(MSC)衍生的EV表面聚糖在细胞摄取中起重要作用,并且使用消失场荧光(evanescent field fluorescence, EFF)辅助凝集素微阵列可以将EV聚糖模式用作MSCs的成骨分化标志物。这种方法的优点是省略了预处理和后处理过程。因此,只需制备荧光标记的EV并检测EV结合凝集素信号,无需洗涤步骤。此外,可以在1天内使用极少量的EV样品(≈0.5µg)对多个EV样品进行综合分析。因此,作者假设该方法适用于表征EV异质性。
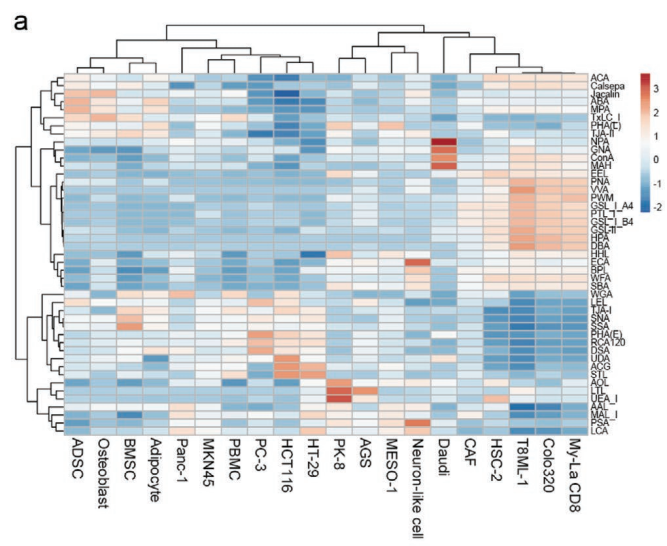
一些研究报告称,EV表面聚糖谱有助于定义每种EV亚型。有研究通过凝集素印迹分析和质谱法比较了三种不同大小EV的聚糖模式,包括来自三种细胞系的外泌体、小型EV(60-80nm)和大型EV(90-120nm)(https://www.exosomemed.com/4061.html)。结果揭示了依赖于细胞类型和EV亚型的不同聚糖谱。另一项研究使用凝集素微阵列比较了来自两个细胞系的EV的聚糖谱,并确定了几种在它们之间具有不同结合信号的凝集素。
EV表面聚糖在EV异质性和细胞-EV相互作用中的作用
在这项研究中,作者使用EFF-凝集素阵列根据其细胞类型、大小和分离方法对EV表面聚糖进行了更详细的比较,以评估EV聚糖谱是否可以用作EV亚群的指标(图1)。此外,使用糖苷酶和糖基转移酶进行EV糖工程,制备具有四种不同表面聚糖模式的EV,并评估其细胞摄取效率。研究确定了在每种实验条件下获得的EV上聚糖模式的相似性和差异。具体来说,获得了依赖于EV大小和分离方法的特定凝集素结合模式,并且EV的细胞摄取行为受到受体细胞和EV聚糖谱的影响。研究还发现EV的体内生物分布取决于它们的聚糖。这项研究表明,EV表面聚糖为EV异质性提供了一种潜在的新指标,而糖工程是操纵EV-细胞相互作用的有用技术。
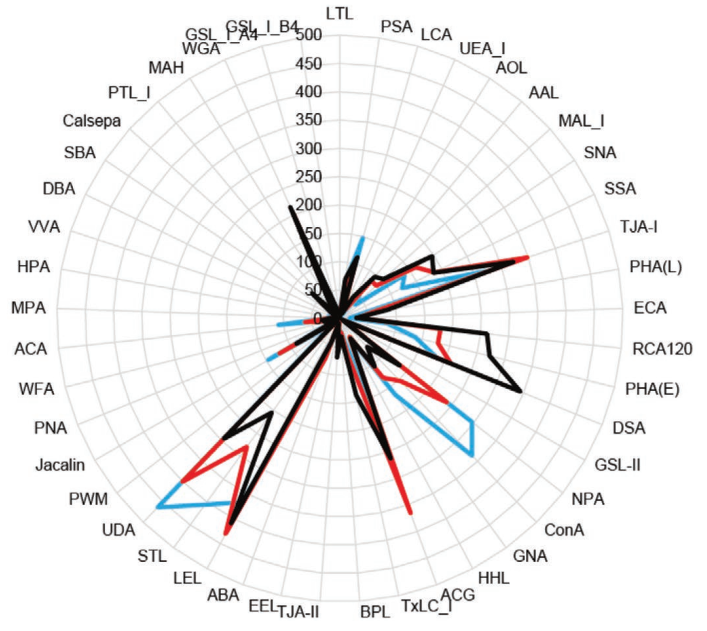
使用凝集素微阵列对来自20个细胞系的sEV进行聚糖分析
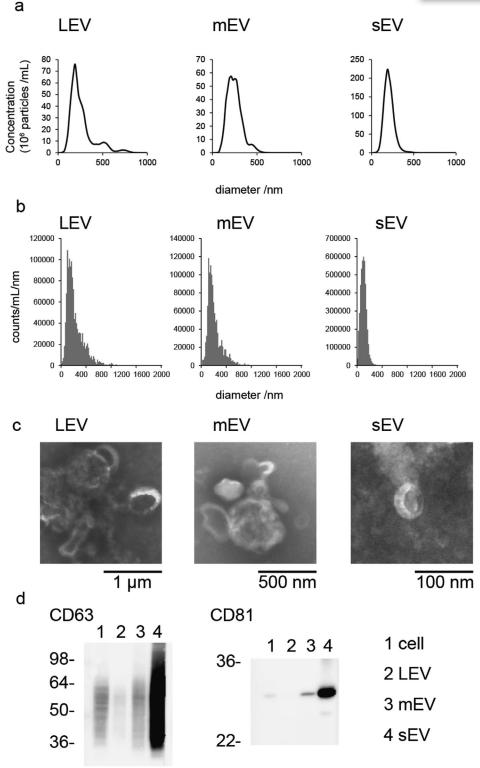
PC3细胞衍生EV的表征
来自PC3细胞的EV的聚糖谱
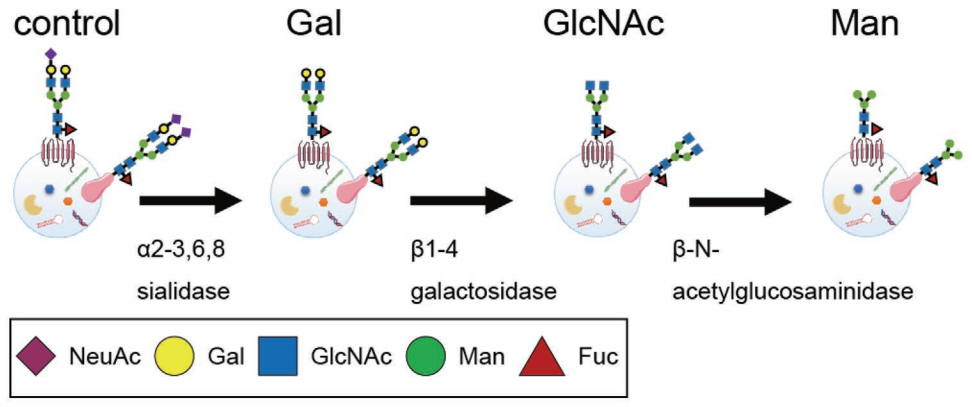
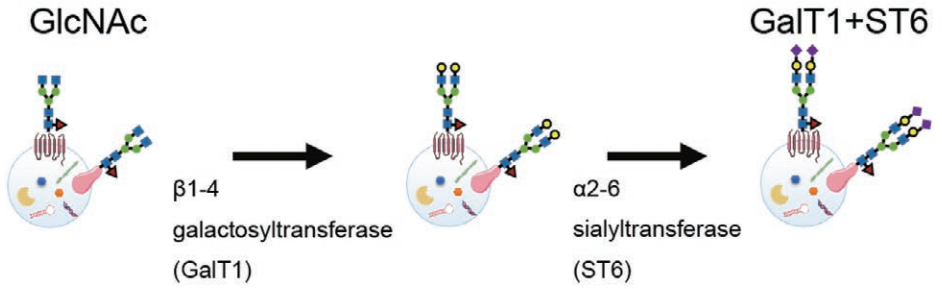
使用糖苷酶和糖基转移酶修改EV表面聚糖
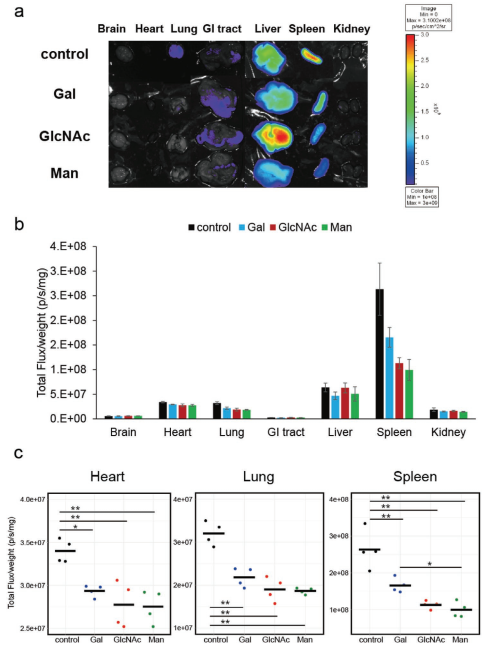
静脉注射24小时后小鼠体内糖工程ADSC-sEVs的体内生物分布
参考文献:
ShimodaA, Miura R, Tateno H, Seo N, Shiku H, Sawada SI, Sasaki Y, Akiyoshi K.Assessment of Surface Glycan Diversity on Extracellular Vesicles by LectinMicroarray and Glycoengineering Strategies for Drug Delivery Applications.Small Methods. 2022 Feb;6(2):e2100785. doi: 10.1002/smtd.202100785. Epub 2021Dec 1. PMID: 35174988.