肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一。索拉非尼(so)具有良好的抗癌活性。然而,在没有递送载体辅助的临床应用中,so表现出低水溶性、短半衰期和较差的稳定性,需要频繁的高剂量给药。化疗药物与小干扰RNA(siRNA)的组合已成为一种很有前景的癌症治疗方法,显示出与单独用药相比增强的抗肿瘤功效。细胞外囊泡作为一种新型生物截止,在药物递送领域显示出广泛的应用潜力。最新研究发现,骆驼乳源性细胞外囊泡被证明具有高生物相容性及抗炎活性,并对诱导HCC细胞凋亡有显著影响。因此通过骆驼乳源性细胞外囊泡联合用药可以在药物抑制肿瘤生长的同时,通过加入siRNA沉默癌基因,减少药物剂量,克服传统化疗药物的主要局限性。
近日,上海海洋大学刘科海教授团队在Journal of Controlled Release 杂志发表题为“Camel milk extracellular vesicles-mediated co-delivery of siVEGF/sorafenib enhances the anti-hepatocellular carcinoma activity by dual-effect blocking the biological effects of VEGF”的论文,构建了一种基于骆驼奶源性细胞外囊泡的共递送系统(so-cEVs-PPT/siVEGF),联合治疗策略为肝细胞癌的治疗提供了新的视角和可能性。
该研究鉴于VEGF在肿瘤组织中的旁分泌和自分泌的联合作用,提出使用索拉非尼阻断VEGF信号通路,siRNA干扰肿瘤细胞自分泌VEGF,从而实现对VEGF生物效应的双效阻断,进一步提高抗肿瘤疗效。研究利用tLyP-1多肽可以特异性靶并结合于肿瘤细胞表面的特性,开发了一种新型的共递送系统(so-cEVs-PPT/siVEGF),可以有效装载so和siRNA并保护siRNA不被酶降解,为递送系统在肿瘤组织中靶向并保持药物持续释放提供可能。
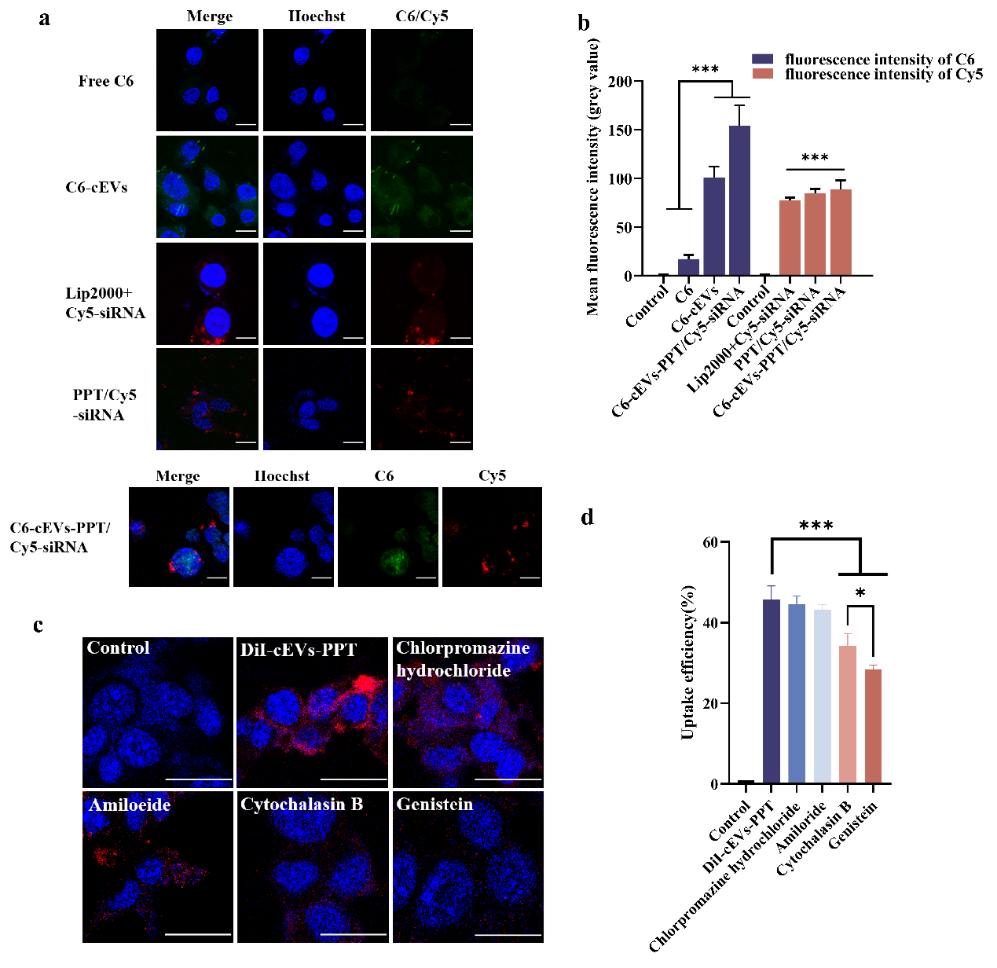
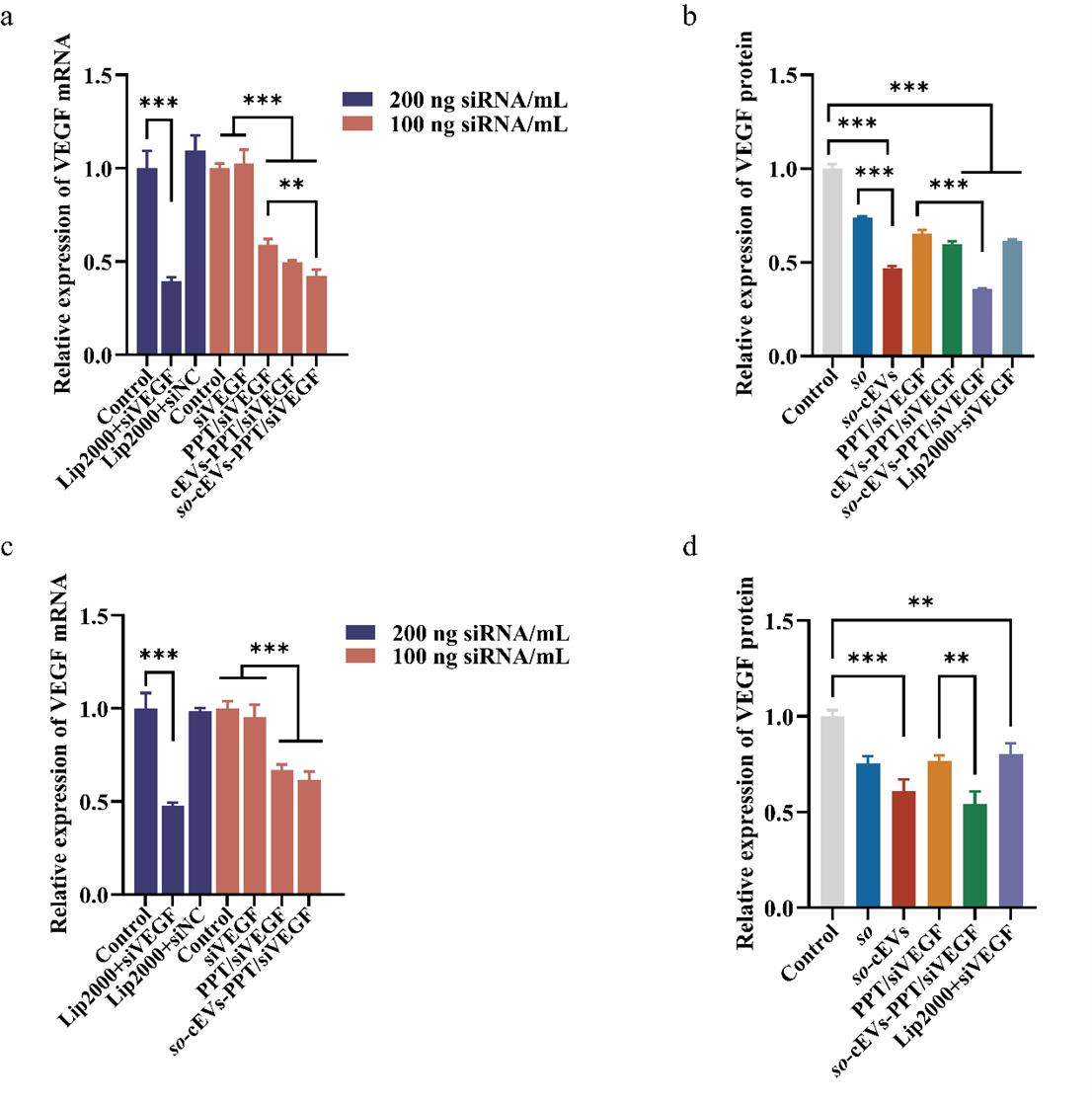
体外细胞摄取研究表明so-cEVs-PPT/siVEGF高效内化到HepG2细胞中。so通过干扰肿瘤微血管和抑制多种酪氨酸激酶受体(包括 VEGF 受体)的活性来抑制肿瘤生长,通过比较发现so-cEVs-PPT/siVEGF能够显著沉默VEGF的mRNA和蛋白表达,证实cEVs能够促进so的疗效实现so的有效递送。
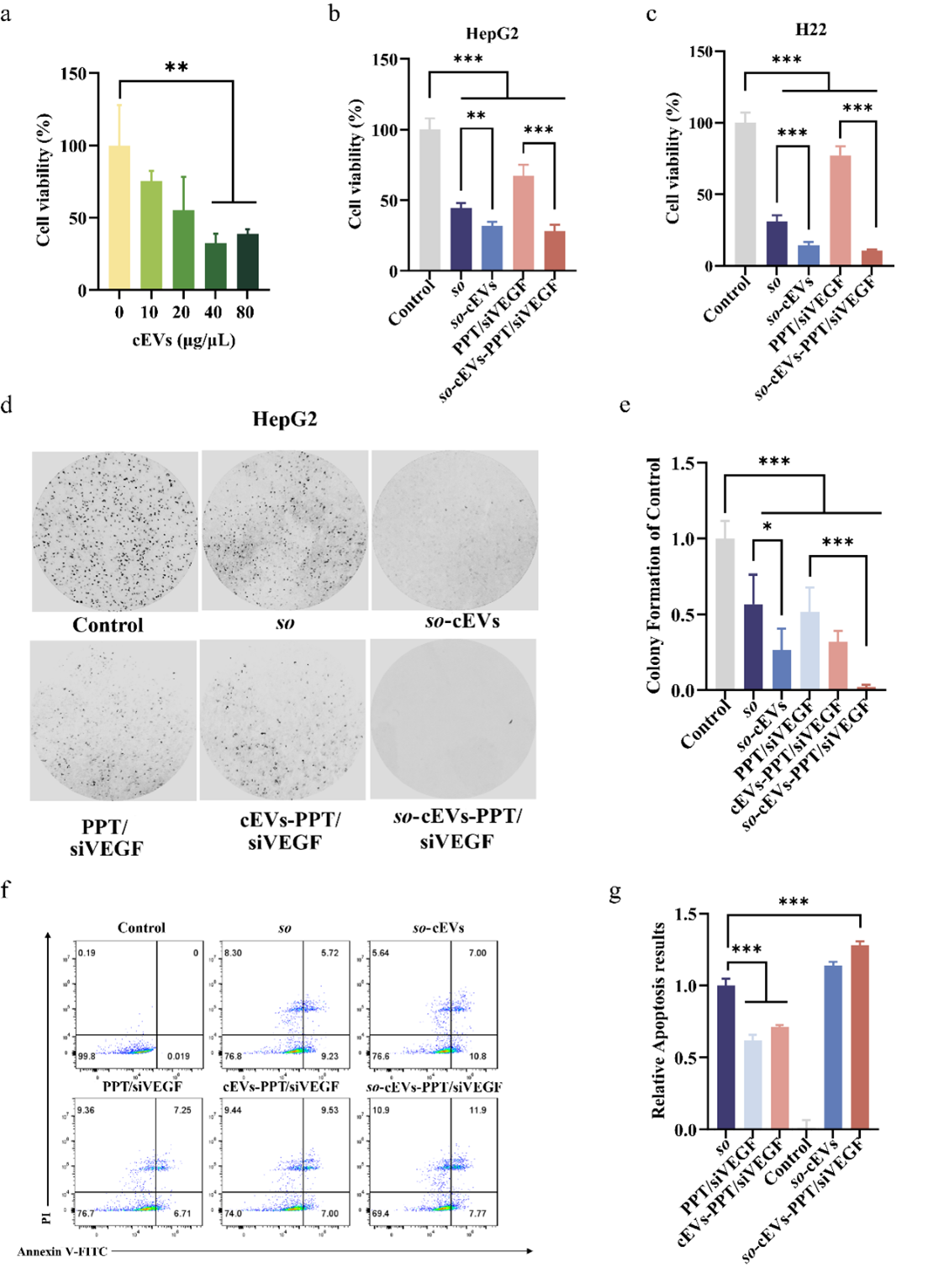
进一步探究so-cEVs-PPT/siVEGF的体外抗肿瘤能力。结果表明so和siVEGF联合治疗能够通过诱导细胞凋亡、抑制细胞迁移和侵袭和抑制VM形成的方式,显著抑制肿瘤细胞的生长,具有潜在增强抗肿瘤能力。
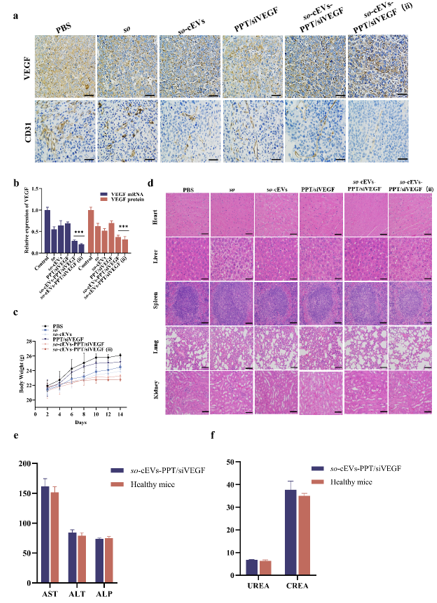
为了探究so-cEVs-PPT/siVEGF的体内抗肿瘤效果,使用各制剂尾静脉注射对小鼠进行治疗。so-cEVs-PPT/siVEGF能够随着时间的推移在肝脏和肿瘤部位靶向蓄积。so-cEVs-PPT/siVEGF处理后肿瘤组织中VEGF表达降低,具有良好的抗肿瘤作用效果。所有结果共同表明,so-cEVs-PPT/siVEGF能够有效装载so和siRNA,具有良好的抗肿瘤效果。
该研究凭借tLyP-1的靶向和cEVs的递送载体优势,实现治疗分子在靶细胞中的积累和释放,表现出显著的抗肿瘤作用,且未对肝功能造成损害。这种将化疗和基因药物用天然来源的纳米结构共递送系统为HCC提供了新的治疗策略。
参考文献:
Camel milk extracellular vesicles-mediated co-delivery of siVEGF/sorafenib enhances the anti-hepatocellular carcinoma activity by dual-effect blocking the biological effects of VEGF. Journal of Controlled Release. Volume 385, 2025, 113980.https://doi.org/10.1016/j.jconrel.2025.113980.
外泌体资讯网 J CONTROL RELEASE |上海海洋大学刘克海:骆驼乳外泌体siVEGF/sorafenib共递送系统用于肝细胞癌治疗