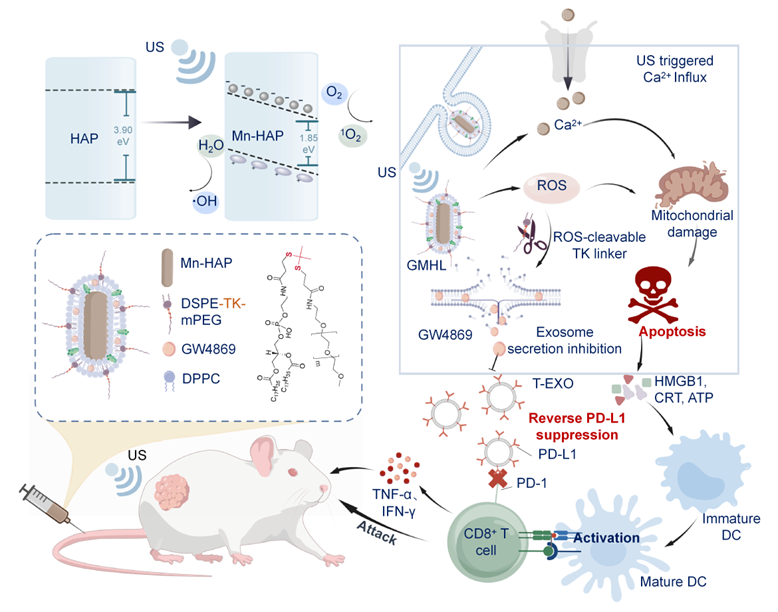
压电纳米材料因其在机械刺激下通过压电极化反应产生活性氧(ROS)的特性,成为肿瘤治疗领域极具潜力的新平台。然而,目前压电纳米材料的实际应用还面临着多重瓶颈:包括压电响应效果不理想,催化效率难以满足治疗需求,更关键的是,在治疗过程中,大量ROS的产生会诱导肿瘤释放外泌体,而这些携带PD-L1分子的肿瘤源性外泌体又恰恰会加剧肿瘤部位的免疫抑制状态,制约着压电纳米材料在癌症治疗中的应用潜力。
近日,山东第一医科大学医学科技创新中心董自亮教授团队在Journal of Nanobiotechnology(IF=12.6)上发表了题为“Synergizing Sono-Piezo with Exosome Suppression Using Doping-Engineered Hydroxyapatite for Potentiated Tumor Treatment through Immunoactivation”的研究论文。该团队通过锰离子掺杂工程优化羟基磷灰石纳米棒的压电性能,并创新性地结合外泌体抑制剂GW4869,构建了多功能纳米复合材料GMHL,实现了压电催化增效与免疫抑制微环境逆转的双重效果,更有效地激活免疫从而增效肿瘤治疗。山东第一医科大学生物医学科学学院屈欣然为论文第一作者,山东第一医科大学董自亮教授、刘营营副教授以及南京大学医学院附属鼓楼医院庄儒麟特聘副研究员为论文的共同通讯作者。

这项研究通过一锅水热法合成了掺杂锰离子的羟基磷灰石纳米棒,并通过ROS响应性脂质DSPE-TK-mPEG进行表面修饰,同时负载外泌体抑制剂GW4869,构建了多功能压电纳米复合材料GMHL。Mn2+的引入大幅降低了纳米材料带隙,增强超声刺激下压电催化活性,促进了ROS产生,进而特异性地裂解脂质层释放外泌体抑制剂。在小鼠结肠癌(CT26)和黑色素瘤(B16-F10)肿瘤模型中,GMHL联合超声治疗组较对照组表现出显著的肿瘤生长抑制效果,并且能够有效抑制携带PD-L1肿瘤外泌体的产生,调节免疫抑制性肿瘤微环境,激活抗肿瘤免疫反应。该研究通过阻断外泌体介导的免疫抑制通路,实现了压电催化治疗与外泌体阻断的协同增效,为克服肿瘤免疫抑制微环境提供了新的材料策略和治疗思路。
参考文献:
Synergizing sono-piezo with exosome suppression using doping-engineered hydroxyapatite for potentiated tumor treatment through immunoactivation. J Nanobiotechnology. 2025 Jul 8;23(1):495. doi: 10.1186/s12951-025-03564-y.
外泌体资讯网 J Nanobiotechnology|山东第一医科大学董自亮:基于掺杂改性羟基磷灰石的声致压电-外泌体抑制联用增效抗肿瘤治疗




