大量研究表明肠道微生物群通过肠-脑轴的神经炎症过程参与阿尔茨海默病(AD)等神经退行性疾病的发生和发展。尽管如此,肠道微生物参与AD的确切机制仍然不完全清楚。
近日,来自比利时根特大学VIB炎症研究中心的研究发现,肠道微生物群来源外膜囊泡是肠-脑轴对话的重要媒介并对塑造AD有重要作用。相关内容以 “The gut–brain axis in Alzheimer’s disease is shaped by commensal gut microbiota derived extracellular vesicles”为题在线发表于5月12日的国际微生物学知名期刊Gut microbes杂志上。比利时根特大学VIB炎症研究中心助理研究员谢俊华(现为南昌大学食品科学与资源挖掘全国重点实验室特聘研究员)和Lien Van Hoecke为论文共同第一作者,VIB炎症研究中心Roosmarijn E. Vandenbroucke教授为该文章的通讯作者。
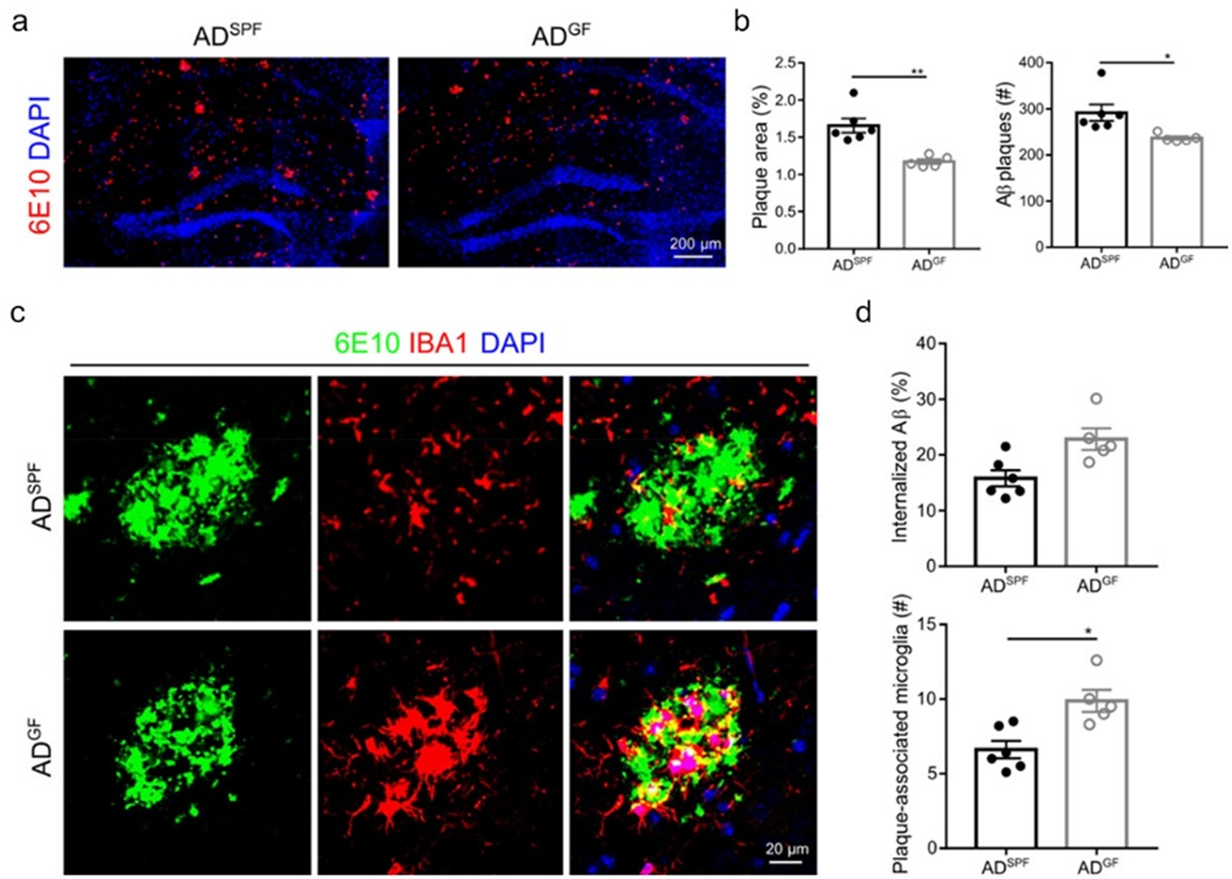
研究团队首先利用第二代AD小鼠构建了无菌(GF)动物模型,在GF条件下饲养的AD小鼠显著降低了大脑β淀粉样蛋白(Aβ)病理,其同时伴随着小胶质细胞向炎症较少的状态转变和吞噬效率增加。此外,研究人员证明肠道微生物群耗竭可以防止 AD小鼠的突触缺陷且其与小胶质细胞吞噬功能变化相关,与团队之前的研究结果一致(Xie et al., J Extracell Vesicles. 2023)。
图1. 肠道菌群对Aβ病理的影响
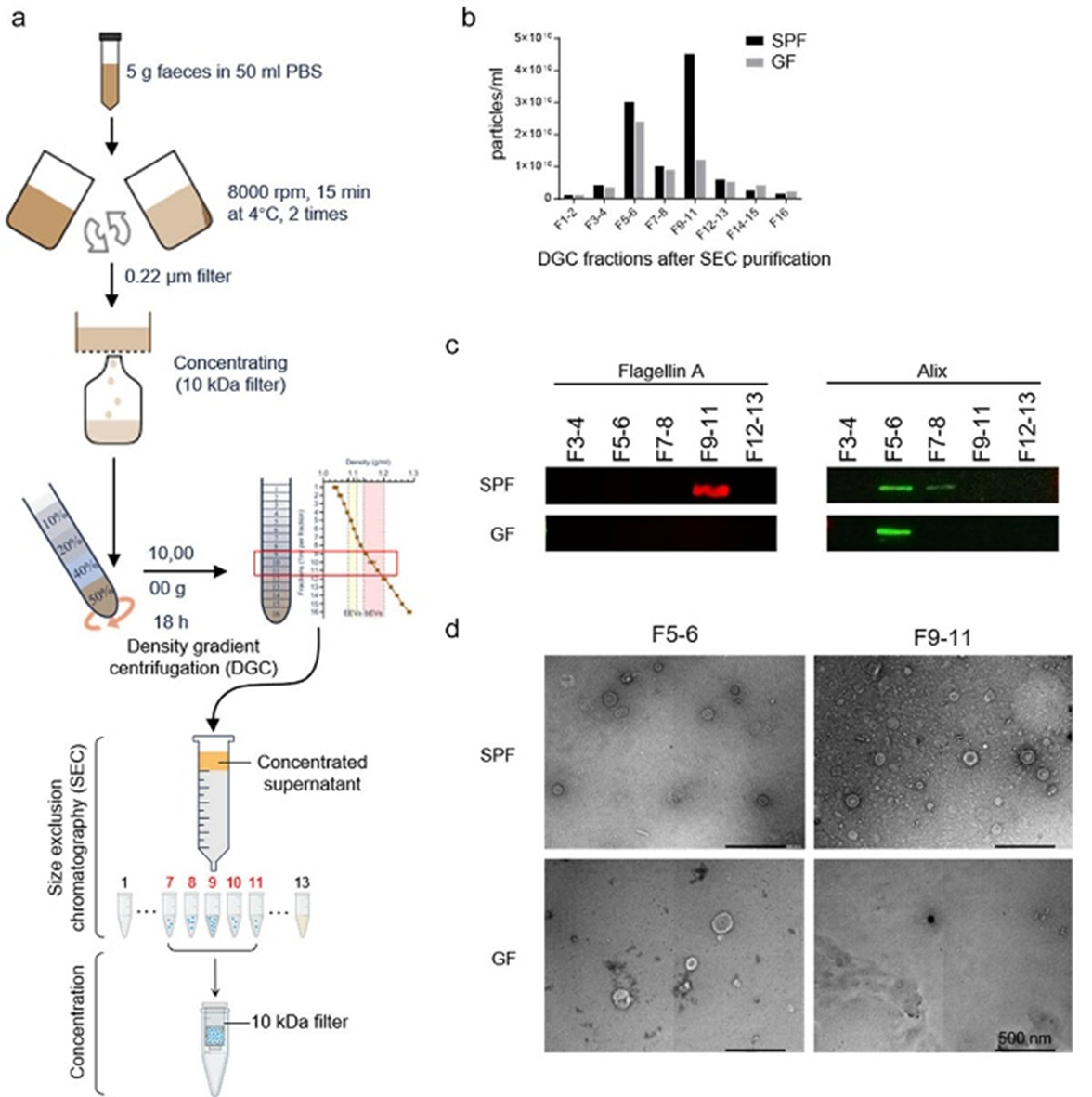
该团队进一步研究发现,提取来自AD小鼠粪便的细菌外膜囊泡逆转了GF条件对小胶质细胞活化和Aβ病理的积极影响。这些发现表明共生肠道微生物群衍生的外膜囊泡AD的发病机制中发挥了重要作用。
图2. 粪便外膜囊泡的制备及表征
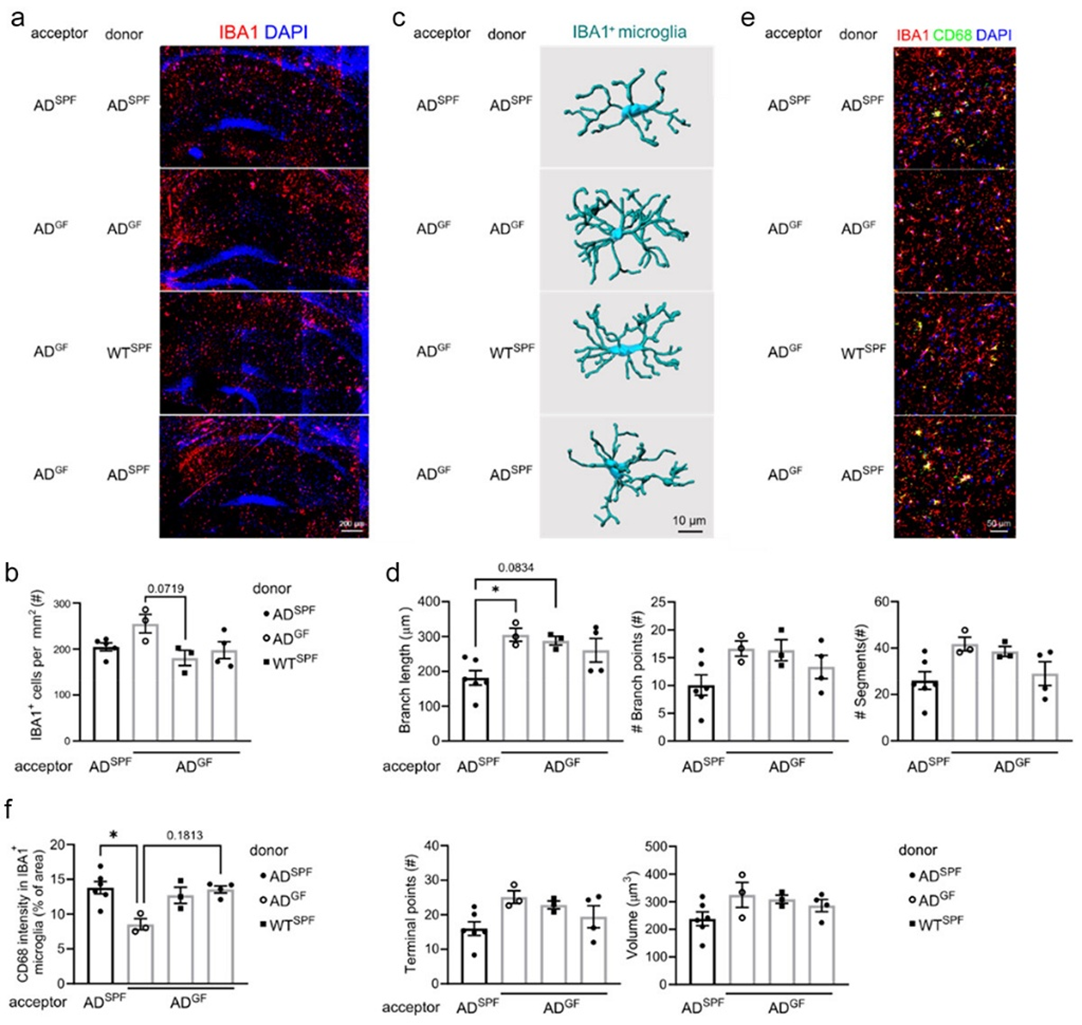
图3. 肠道菌群外膜囊泡对小胶质细胞功能的影响
上述研究结果进一步验证了该团队先前提出的科学设想:细菌外膜囊泡作为新型治疗靶点,有望为疾病的干预开辟全新途径(Xie et al., Trends Microbiol. 2023)。然而,需要特别指出的是,肠道微生物群或特定微生物衍生的外膜囊泡可能涉及与上述影响AD病理相同的途径,但这需要通过进一步的研究来确定。其外,肠道微生物群对AD病理生成的复杂影响可能不是某种特定细菌或代谢产物的结果,而是整体带来的影响。
参考文献:
The gut–brain axis in Alzheimer’s disease is shaped by commensal gut microbiota derived extracellular vesicles. Gut Microbes. 2025 Apr 17(1). https://doi.org/10.1080/19490976.2025.2501193