近年来,尿液中的小细胞外囊泡(small urinary extracellular vesicles, suEVs)逐渐成为研究泌尿系统疾病的"液体活检”热点。suEVs主要来源于泌尿上皮细胞,能够携带疾病相关的蛋白质信息。然而,由于尿液中suEVs浓度较低,且尿液中高丰度的尿调素(uromodulin)会严重干扰suEVs的纯化和质谱检测,使得suEV的蛋白质组学研究仍面临显著挑战。
近日,中国科学院生物物理研究所杨福全研究员团队在国际期刊 Extracellular Vesicle上发表了题为“Optimization and assessment of an integrated workflow for the isolation and proteomic analysis of small urinary extracellular vesicles (suEVs)”的研究论文。该研究系统比较并优化了suEVs的分离方法及其后续的溶液酶切策略,建立了一套适用于尿液suEVs蛋白质组学研究的完整实验流程,为泌尿系统疾病的临床标志物挖掘和诊断研究提供了关键支持。杨福全研究员、陈秀兰副研究员为该论文的共同通讯作者,硕士研究生胡艺蓝为第一作者。
在本研究中,作者系统比较了四种尿液suEVs的分离方法,包括经典的超速离心(UC)、DTT预处理结合超速离心(DTT+UC)、过滤结合超速离心(F+UC)以及过滤结合超滤(F+UF)(图1a)。结果显示,F+UC方法在回收率、样本纯度和蛋白质组鉴定深度方面表现最优,可有效去除高丰度尿调素(uromodulin)并获得高质量的suEVs蛋白组数据。此外,作者还对比了不同溶液酶切方法,发现对于EV这种高膜蛋白含量的特殊样品来说,基于三氟乙醇TFE的蛋白溶液酶切策略较传统尿素法在蛋白识别数量与膜蛋白富集方面具有优势。
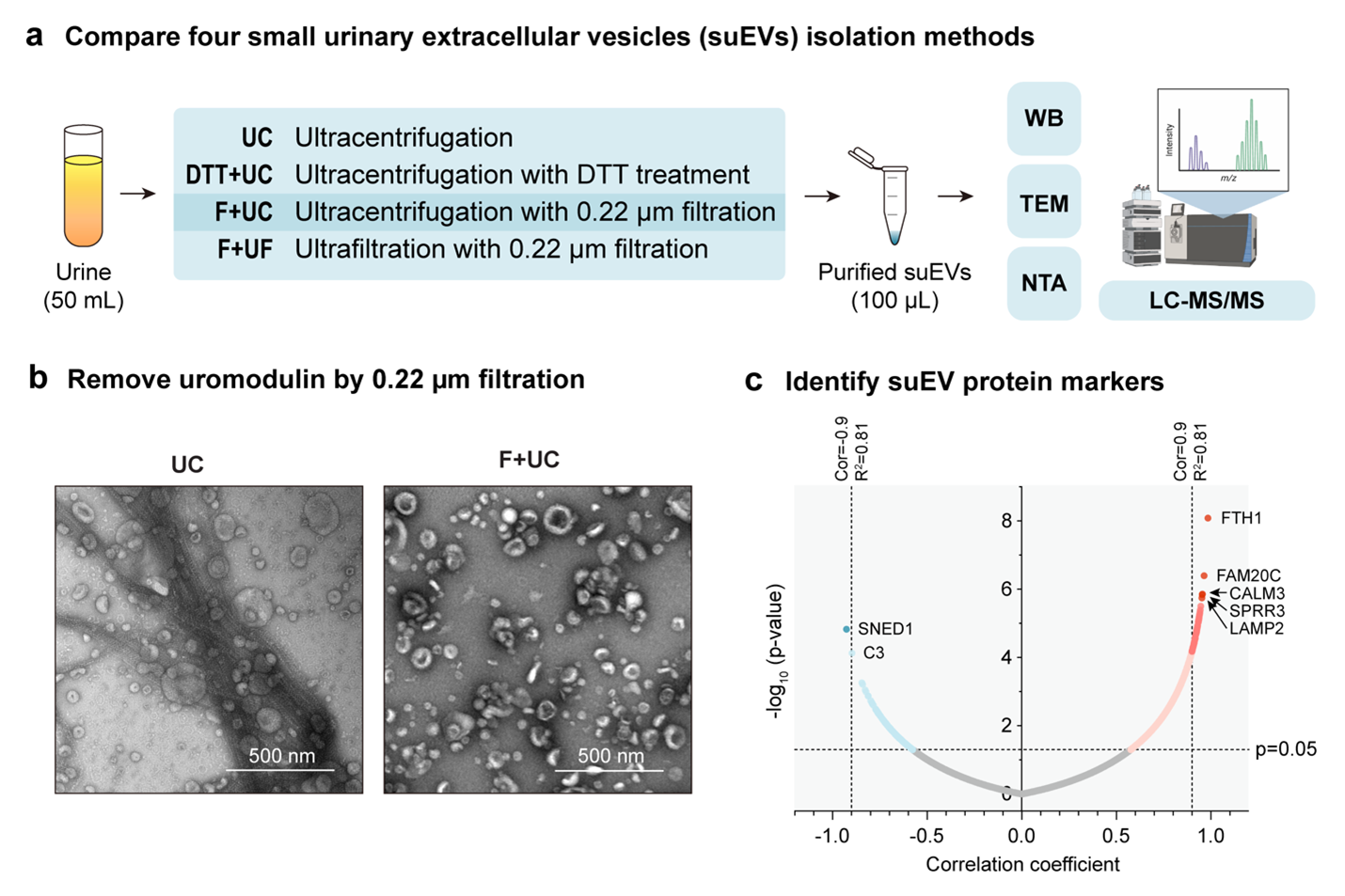
图1: 核心发现示意图
尿调素一直是影响suEVs的分离纯化和限制suEVs质谱鉴定深度的主要干扰因素。尽管DTT还原处理可部分去除尿调素,但同时会造成EV表面损伤、和蛋白质组成的变化。相比之下,使用0.22 μm膜过滤不仅可高效清除大部分尿调素纤维网络(图1b),而且对EV结构无显著影响,避免了DTT带来的蛋白构象变化和功能干扰。因此,研究推荐在suEV蛋白质组学研究中采用“0.22 μm膜过滤+UC”的组合策略,以在保证样本纯度的同时获得高的蛋白组覆盖度。
不同分离方法会为同一个样品带来蛋白质组鉴定的差异。为此,作者进一步建立了一种基于纯度相关性的统计方法,用于识别不同方法下均具有代表性的suEV蛋白标志物(图1c)。通过分析四种分离方法的联合蛋白组数据,最终筛选出61种与EV纯度显著正相关的通用蛋白,包括在EV工程研究中具有重要作用的LAMP2等关键分子。传统的外泌体标志物如ALIX,TSG101和CD9等也表现良好。
本研究不仅构建了适用于suEVs的高效分离与蛋白组学分析流程,而且还提出了一种与分离方法无关的suEVs通用蛋白筛选策略,具有推进尿液EV在临床转化中的应用潜力。免费原文链接:https://authors.elsevier.com/sd/article/S2773-0417 (25) 00012-5
参考文献:
Yilan Hu, Jifeng Wang, Xiaoqing Qing, Tanxi Cai, Lili Niu, Xiang Ding, Zhensheng Xie, Mengmeng Zhang, Xiaojing Guo, Xiulan Chen, Fuquan Yang, Optimization and assessment of an integrated workflow for the isolation and proteomic analysis of small urinary extracellular vesicles (suEVs), Extracellular Vesicle, Volume 5, 2025, 100076, ISSN 2773-0417, https://doi.org/10.1016/j.vesic.2025.100076.
外泌体资讯网 Extracellular Vesicle | 中国科学院生物物理研究所杨福全团队:建立尿液suEVs分离和蛋白质组学标准流程





