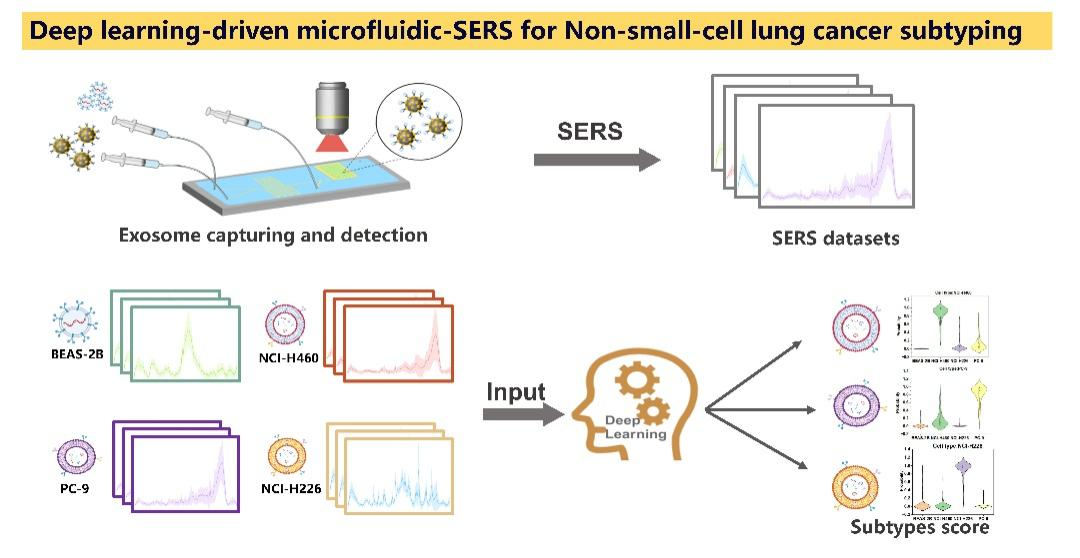
肺癌是全球癌症相关死亡的主要原因,其高度异质性和复杂的分子分型为精准诊疗带来了重大挑战。尽管传统组织活检被认为是诊断的“金标准”,但其具有侵入性强、成本高以及难以提供全面分子信息等局限性,无法完全捕捉疾病的复杂性,及满足临床对肿瘤动态监测的需求。近年来,外泌体作为一种携带肿瘤特异性分子标志物的纳米级囊泡,为液体活检技术的发展提供了新方向。解析外泌体的分子异质性被认为是实现肺癌早期诊断和分子分型的重要突破口。然而,生物基质中的外泌体,尺寸仅30-200 nm,其低丰度捕获、高灵敏检测及多维度解析成为现阶段难点。现有技术往往受限于分离效率低、信号干扰强、分析维度单一等问题,难以精准捕捉外泌体分子特征的细微差异。尤其面对占肺癌85%的非小细胞肺癌(NSCLC),其腺癌、鳞癌等亚型的分子分型精度关系到靶向治疗的成败,这对检测技术的灵敏度与特异性提出了更高要求。
近日,上海理工大学张学典教授团队在ACS Sensors杂志上发表题为“Deep Learning-driven Microfluidic-SERS to Characterize the Heterogeneity in Exosomes for Classifying Non-small-cell Lung Cancer Subtypes”的文章,融合深度学习的智能解析能力、微流控芯片的精准操控优势及SERS光谱的分子指纹识别特性,成功构建了"三位一体"的外泌体分析平台。该平台实现了针对外泌体高达85%的高效富集,并基于深度学习模型解析外泌体分子特征差异,在NSCLC亚型鉴别中取得97.88%的准确率,各亚型AUC值均突破0.95。同时模型中Grad-CAM(梯度加权类映射)将光谱特征峰对模型决策的重要性进行可视化,打破传统黑箱模型的壁垒,极大提升模型的透明度,为临床决策提供可解释的分子依据。这项工作不仅为外泌体异质性解析提供新的技术,更为实现肺癌精准分子分型提供创新性解决方法。该论文第一作者和通讯作者为上海理工大学陈辉副教授。

该研究开发了一种集成微流控芯片、无标记SERS与可解释深度学习的多模态检测平台,用于NSCLC的早期诊断及分子分型。核心技术包括:(1)构建金纳米立方体-聚苯乙烯微球复合探针,通过氨基-羧基键定向修饰anti-CD-9抗体,实现对外泌体的特异性捕获与SERS信号同步增强;(2)设计并制备微流控芯片,通过混合室完成外泌体-复合探针高效结合,并基于尺寸筛选原理在捕获室实现外泌体的精准富集及检测;(3)构建Grad-CAM增强的深度学习模型对SERS光谱进行分析,通过解析三种NSCLC细胞与正常细胞外泌体的光谱特征,实现肺癌亚型智能鉴别(整体准确率97.88%,各亚型AUC>0.95),同时为模型决策提供关键的可解释性分子特征解析。该研究基于可解释深度学习融合微流控-SERS技术获取外泌体指纹图谱并构建肺癌分子分型模型,有望为肺癌精准诊疗提供兼具高灵敏度、分子分型精度及临床可解释性的创新解决方案。
研究示意图

NSCLC亚型分类结果及SERS光谱特征权重可视化
参考文献:
Deep Learning-driven Microfluidic-SERS to Characterize the Heterogeneity in Exosomes for Classifying Non-Small Cell Lung Cancer Subtypes. ACS Sensors. 2025 April. DOI: 10.1021/acssensors.4c03621.
外泌体资讯网 ACS Sensors|上海理工大学庄松林院士/张学典:可解释深度学习联合SERS光谱解码外泌体异质性实现肺癌细胞分子分型