胃癌是全球范围内最常见且致命的恶性肿瘤之一,改善胃癌患者临床预后的关键在于对可治疗阶段的胃癌患者进行及时诊断。近年来,基于细胞外囊泡(EVs)的液体活检在胃癌早期筛查过程中展现了广阔的应用前景。另一方面,作为生命活动的最终产物,代谢物的水平变化反映了基因转录与蛋白调控后的综合生物学效应,能够更直接地指示疾病的发生与发展状态。
为了推动基于EVs代谢组学的胃癌早期诊断研究,中国科学院理化技术研究所王树涛教授、宋永杨研究员团队与首都医科大学附属北京友谊医院闵力教授团队创新性地采用“尺寸互补基础上的分子亲和”策略,开发出了一套高效、高特异性、无损的EVs分离体系。结合集成式机器学习算法,对血浆EVs代谢组学进行了系统分析,成功实现了早期胃癌的精准诊断。相关研究近日以“Efficient Metabolomics Profiling from Plasma Extracellular Vesicles Enables Accurate Diagnosis of Early Gastric Cancer”为题发表于Journal of the American Chemical Society。文章第一作者为首都医科大学附属北京友谊医院卜凡钦博士与中国科学院理化技术研究所沈欣怡博士。通讯作者为首都医科大学附属北京友谊医院闵力教授、中国科学院理化技术研究所宋永杨研究员与王树涛教授。
纳米尺度下的“EVs结构契合”材料制备
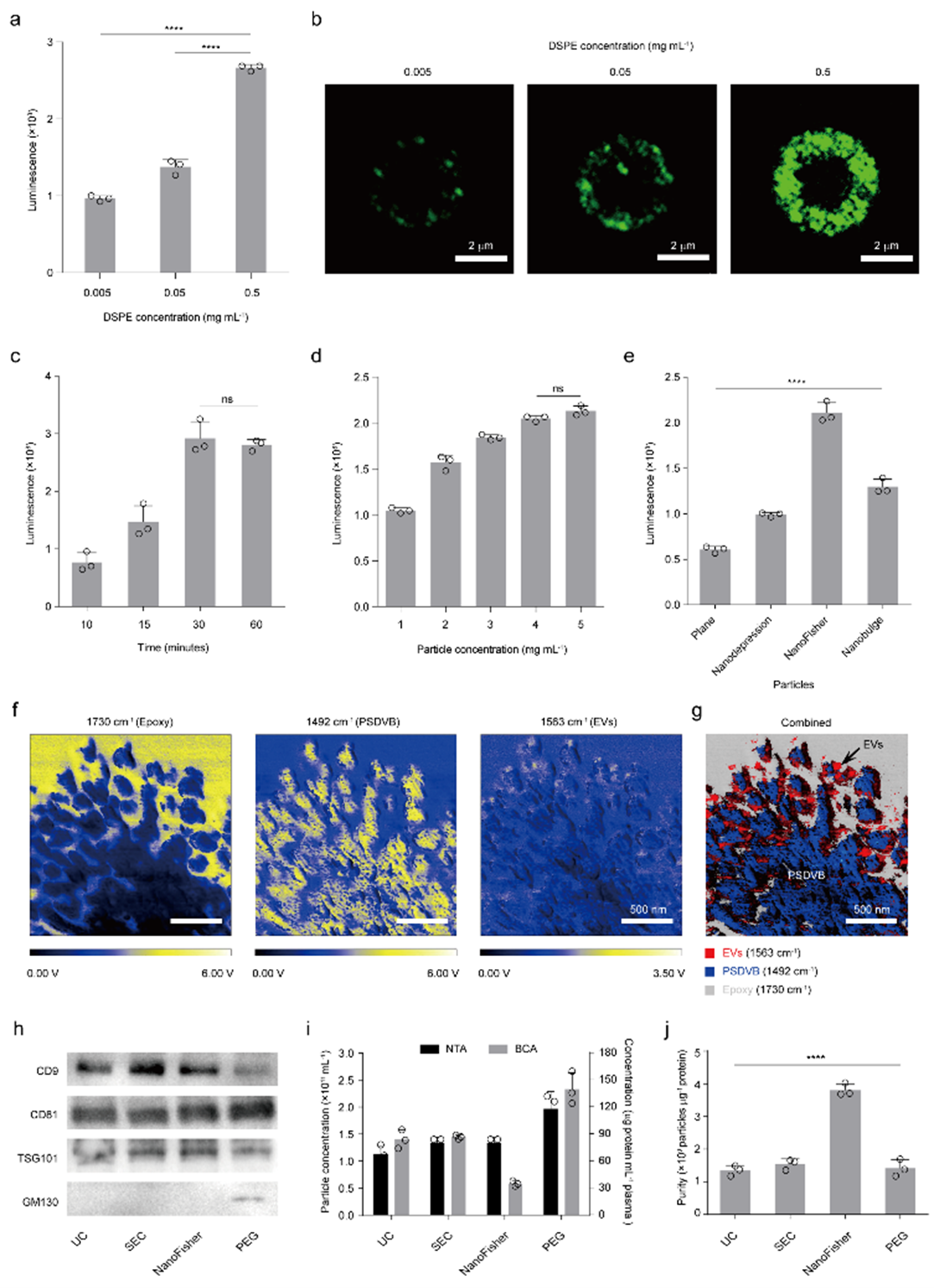
在该部分,研究者基于静电相互作用调控下的乳液界面聚合策略制备了多种表界面纳米分形结构,尺寸匹配的纳米间隙有助于实现EVs在材料表面的三维立体嵌入,进而为 EVs 与捕获探针之间的相互作用提供多维接触位点(图1)。
图1. 具有可控表界面纳米结构的微粒合成
EVs分离性能测试
通过将捕获探针偶联至微球表面,研究者从分离效率、纯度和无损性等方面系统性地评估了基于纳米材料的EVs分离性能,并构建了基于NanoFisher微球的EV分离体系,为后续的代谢组学研究奠定基础(图2)。
图2. EV分离性能检测
EVs代谢组学分析
为了实现更优的疾病诊断性能,在鉴定出疾病特异性分子标志物后,我们采用有监督学习与无监督学习算法的交叉集成分析,优化标志物组合筛选,最终显著提高了诊断性能,增强了代谢物模型的外推能力与泛化效果(图3)。
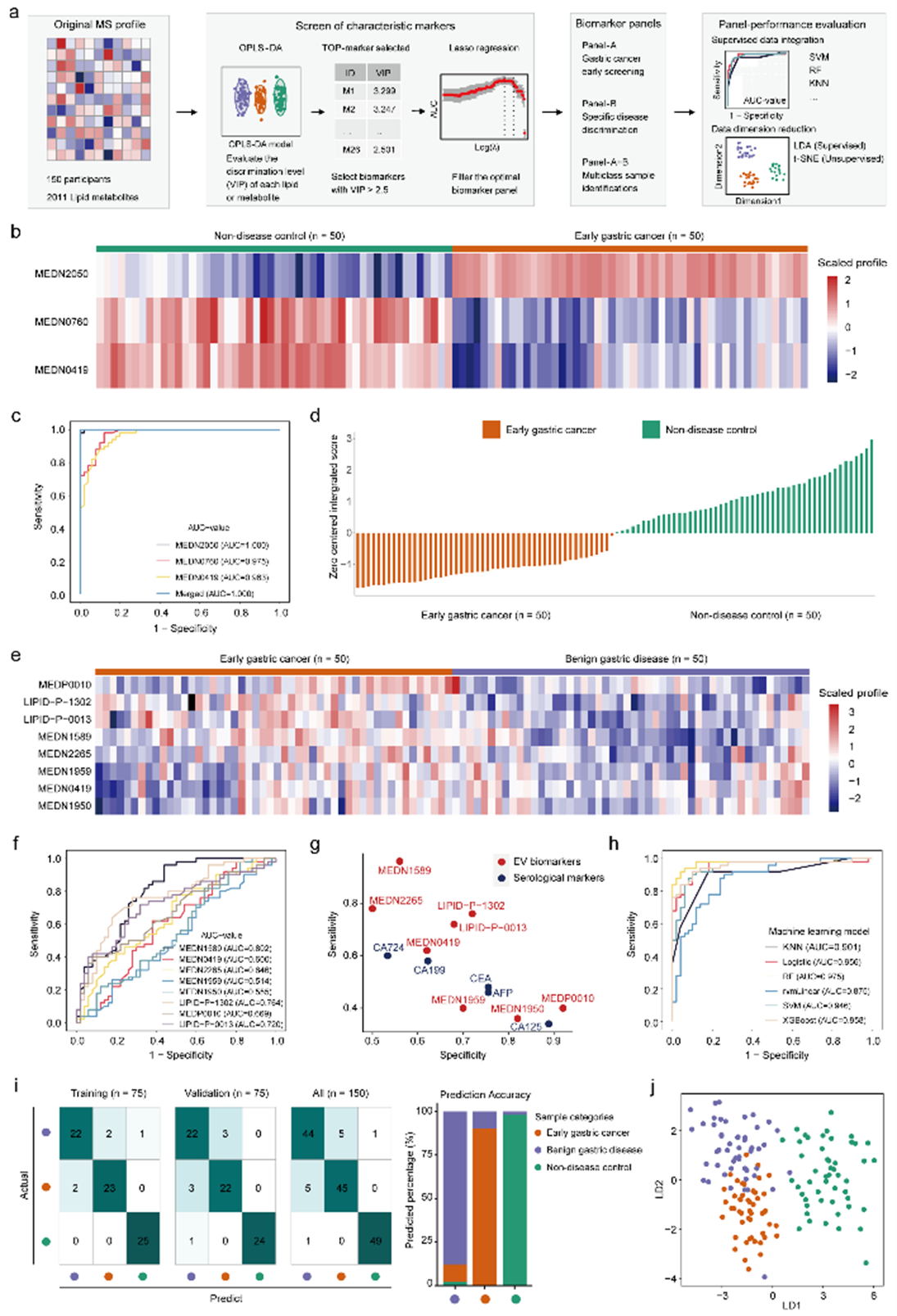
图3. 基于EV代谢组学的胃癌早期诊断过程
NanoFisher提供的高性能捕获能力为从多种体液中分离EVs开辟了广阔的应用前景,支持多组学研究,并显著提升了在不同疾病谱系之间的区分能力。
参考文献:
Efficient Metabolomics Profiling from Plasma Extracellular Vesicles Enables Accurate Diagnosis of Early Gastric Cancer. J Am Chem Soc. 2025 Mar 12; 147(10): 8672-8686. doi: 10.1021/jacs.4c18110.
外泌体资讯网 J Am Chem Soc|中国科学院王树涛/宋永杨/首医附属北京友谊医院闵力:血浆细胞外囊泡代谢组学分析实现早期胃癌的精确诊断