大多数多发性骨髓瘤(MM)患者都会出现治疗耐药性,MM耐药的关键机制之一来自MM细胞与脂肪细胞之间的相互作用,抑制MM细胞的药物诱导的凋亡。来自美国休斯顿卫理公会癌症中心的研究人员在J Exp Clin Cancer Res杂志上发表文章,发现MM细胞可能调节LncRNA 富集到脂肪细胞外泌体中,脂肪细胞来源的外泌体LncRNA 抑制化疗诱导的MM细胞凋亡,揭示了MM细胞和脂肪细胞之间恶性循环的细胞学机制。
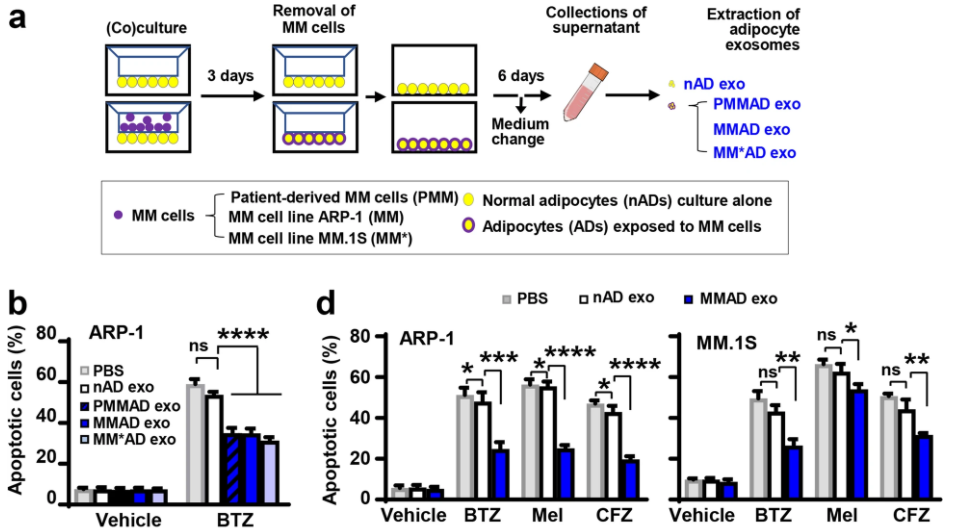 多发性骨髓瘤 (Multiple myeloma,MM) 是一种在骨髓中积聚产生抗体的浆细胞的恶性肿瘤,是美国第二大最常见的血液系统恶性肿瘤,据估计占所有血液系统恶性肿瘤的10%以上。目前MM的治疗药物包括蛋白酶体抑制剂硼替佐米或卡非佐米,为患者提供了显著的益处。然而,大多数MM患者会出现复发或难治性疾病,耐药性成为治愈的主要障碍。因此,了解MM耐药的分子机制将是提高MM治疗药物疗效和延长患者生存期的关键。 作为MM细胞所在的骨髓中最丰富的基质细胞之一,脂肪细胞已被证明参与了MM的发展和发病机制,而不仅仅是为细胞提供能量的唯一功能。脂肪细胞可以促进MM生长,介导肥胖诱导的肿瘤发生,将肿瘤细胞募集到特定的骨区域,并调节破骨细胞和成骨细胞的分化和活性。值得注意的是,骨髓脂肪细胞通过抑制化疗诱导的肿瘤细胞凋亡而导致MM耐药。虽然研究表明脂肪细胞分泌的许多脂肪因子对MM治疗具有保护作用,但其他脂肪细胞衍生的因素,如细胞外囊泡还有待研究。 另一方面,MM细胞操纵宿主骨髓,使其成为更有利于MM细胞生长和存活的微环境,从而与周围的基质细胞形成恶性循环。例如,脂肪细胞可以被MM细胞重新编程并转变为不同特征的细胞。研究团队此前发现,MM细胞通过上调脂肪细胞中EZH2激活脂肪因子基因启动子中的组蛋白甲基化,并且重编程的脂肪细胞分泌了不同的脂肪因子/细胞因子。其他研究还发现,MM细胞降低脂肪细胞基因表达并诱导脂肪细胞衰老和代谢变化。然而,关于MM细胞对脂肪细胞外泌体产生的影响知之甚少。外泌体是纳米尺寸的细胞外囊泡,被证明对肿瘤与基质细胞通讯和介导基质诱导的肿瘤耐药性很重要。外泌体起源于多泡体,其膜内陷形成腔内囊泡。非编码 RNA,包括长链非编码RNA (LncRNA),可以通过RNA结合蛋白包装并转移到囊泡中。有趣的是,外泌体RNA的包装具有高度选择性,外泌体RNA的差异表达可能与不同的生物学功能有关。此外,一些细胞表达水平相对较低的RNA在分泌的外泌体中高度富集,而这种选择或丰度的生物起源尚未阐明。在这项研究中,研究人员发现从MM患者脂肪细胞收集的外泌体保护MM细胞免受化疗诱导的细胞凋亡。特别是两种LncRNA,LOC606724 和SNHG1,在暴露于脂肪细胞外泌体后在MM细胞中显著上调。MM细胞中升高的LncRNA水平与患者的较差预后呈正相关,表明它们在MM中具有临床相关性。通过敲低或过表达实验证明脂肪细胞外泌体 LOC606724 或 SNHG1 在抑制MM细胞凋亡中的功能作用。LncRNA 和RNA结合蛋白之间相互作用,如甲基转移酶7A (METTL7A)。MM细胞通过METTL7A介导的LncRNAm6A甲基化促进LncRNA包装进入脂肪细胞外泌体。脂肪细胞暴露于MM细胞可通过EZH2介导的蛋白质甲基化增强m6A甲基化中的 METTL7A活性。本研究阐明了富含脂肪细胞的微环境如何加剧MM治疗抵抗的机制,并表明通过阻断这种外泌体介导的恶性循环来提高治疗效果的潜在策略。参考文献:Induction of m6A methylation in adipocyte exosomal LncRNAs mediatesmyeloma drug resistance. J Exp Clin Cancer Res. 2022 Jan 3;41(1):4.
多发性骨髓瘤 (Multiple myeloma,MM) 是一种在骨髓中积聚产生抗体的浆细胞的恶性肿瘤,是美国第二大最常见的血液系统恶性肿瘤,据估计占所有血液系统恶性肿瘤的10%以上。目前MM的治疗药物包括蛋白酶体抑制剂硼替佐米或卡非佐米,为患者提供了显著的益处。然而,大多数MM患者会出现复发或难治性疾病,耐药性成为治愈的主要障碍。因此,了解MM耐药的分子机制将是提高MM治疗药物疗效和延长患者生存期的关键。 作为MM细胞所在的骨髓中最丰富的基质细胞之一,脂肪细胞已被证明参与了MM的发展和发病机制,而不仅仅是为细胞提供能量的唯一功能。脂肪细胞可以促进MM生长,介导肥胖诱导的肿瘤发生,将肿瘤细胞募集到特定的骨区域,并调节破骨细胞和成骨细胞的分化和活性。值得注意的是,骨髓脂肪细胞通过抑制化疗诱导的肿瘤细胞凋亡而导致MM耐药。虽然研究表明脂肪细胞分泌的许多脂肪因子对MM治疗具有保护作用,但其他脂肪细胞衍生的因素,如细胞外囊泡还有待研究。 另一方面,MM细胞操纵宿主骨髓,使其成为更有利于MM细胞生长和存活的微环境,从而与周围的基质细胞形成恶性循环。例如,脂肪细胞可以被MM细胞重新编程并转变为不同特征的细胞。研究团队此前发现,MM细胞通过上调脂肪细胞中EZH2激活脂肪因子基因启动子中的组蛋白甲基化,并且重编程的脂肪细胞分泌了不同的脂肪因子/细胞因子。其他研究还发现,MM细胞降低脂肪细胞基因表达并诱导脂肪细胞衰老和代谢变化。然而,关于MM细胞对脂肪细胞外泌体产生的影响知之甚少。外泌体是纳米尺寸的细胞外囊泡,被证明对肿瘤与基质细胞通讯和介导基质诱导的肿瘤耐药性很重要。外泌体起源于多泡体,其膜内陷形成腔内囊泡。非编码 RNA,包括长链非编码RNA (LncRNA),可以通过RNA结合蛋白包装并转移到囊泡中。有趣的是,外泌体RNA的包装具有高度选择性,外泌体RNA的差异表达可能与不同的生物学功能有关。此外,一些细胞表达水平相对较低的RNA在分泌的外泌体中高度富集,而这种选择或丰度的生物起源尚未阐明。在这项研究中,研究人员发现从MM患者脂肪细胞收集的外泌体保护MM细胞免受化疗诱导的细胞凋亡。特别是两种LncRNA,LOC606724 和SNHG1,在暴露于脂肪细胞外泌体后在MM细胞中显著上调。MM细胞中升高的LncRNA水平与患者的较差预后呈正相关,表明它们在MM中具有临床相关性。通过敲低或过表达实验证明脂肪细胞外泌体 LOC606724 或 SNHG1 在抑制MM细胞凋亡中的功能作用。LncRNA 和RNA结合蛋白之间相互作用,如甲基转移酶7A (METTL7A)。MM细胞通过METTL7A介导的LncRNAm6A甲基化促进LncRNA包装进入脂肪细胞外泌体。脂肪细胞暴露于MM细胞可通过EZH2介导的蛋白质甲基化增强m6A甲基化中的 METTL7A活性。本研究阐明了富含脂肪细胞的微环境如何加剧MM治疗抵抗的机制,并表明通过阻断这种外泌体介导的恶性循环来提高治疗效果的潜在策略。参考文献:Induction of m6A methylation in adipocyte exosomal LncRNAs mediatesmyeloma drug resistance. J Exp Clin Cancer Res. 2022 Jan 3;41(1):4.外泌体资讯网 JECCR:脂肪细胞外泌体LncRNA的m6A甲基化诱导多发性骨髓瘤耐药发生

