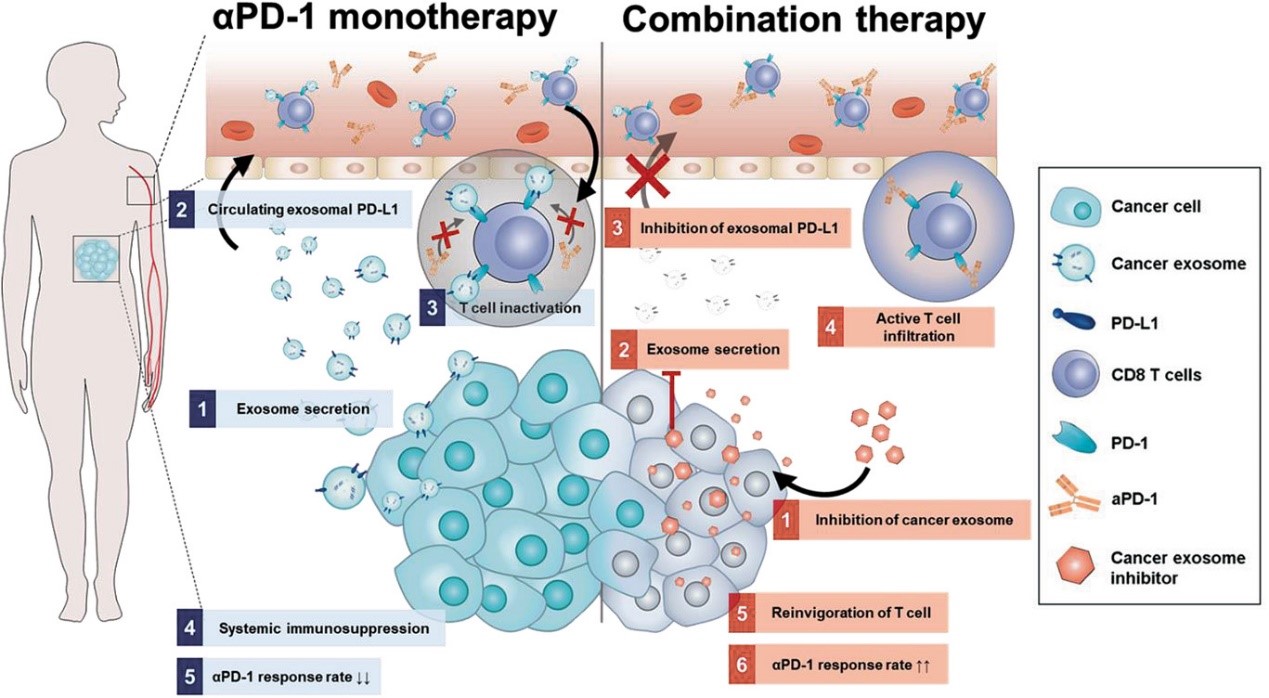
由于肿瘤患者存在的免疫抑制性肿瘤微环境,免疫检查点抑制剂的临床应用因治疗反应不佳受到限制。肿瘤衍生的外泌体被证明可以消耗CD8+细胞毒性T细胞,而且磺胺类抗菌药磺胺异恶唑(SFX)在给荷瘤小鼠口服时显著降低了血液中的外泌体PD-L1水平。来自韩国成均馆大学的研究人员通过联用SFX有效地激活T细胞,与抗PD-1抗体结合产生强大的抗肿瘤作用。该研究发表于Advanced Science杂志上。
免疫疗法是治疗癌症的最有效策略之一,通过调节身体的免疫系统来增强先天性抗肿瘤活性,从而提供出色的临床益处。因此,癌症免疫疗法,例如癌症疫苗接种、免疫检查点阻断剂或嵌合抗原受体CAR-T细胞疗法,最近已成为传统疗法(例如化学疗法、手术和放射疗法)有希望的替代方法和组合疗法的候选。特别是,免疫检查点抑制剂被认为是最有希望的治疗选择之一,因为已被证明在临床上可以显著缓解黑色素瘤、乳腺癌和肺癌等各种癌症类型的肿瘤。与基于自体树突状细胞的疫苗和CAR-T细胞不同,免疫检查点抑制剂可以大规模生产,可供所有癌症患者使用。在免疫检查点治疗(ICT)中,癌症患者接受针对特定免疫检查点分子(如PD-L1、PD-1和 CTLA-4)的单克隆抗体治疗。一旦免疫检查点的负调控被抑制,细胞毒性T细胞的功能就会重新激活,从而消除癌细胞、缓解肿瘤。然而,相当一部分癌症患者(>70%)对免疫检查点抑制剂没有反应,因为癌细胞通常会产生免疫抑制微环境作为其免疫逃逸机制的一部分。为了解决ICT的这种局限性,有必要开发一种新的治疗方法,可以增强细胞毒性T细胞并抑制癌细胞的免疫逃逸机制。大多数真核细胞产生的外泌体(EXO)(直径50-200 nm)通过与受体细胞相互作用或将生物活性物质输送到受体细胞中,在细胞间通讯中发挥关键作用。最近,已经证明癌症EXO主要介导了免疫逃逸机制和随后对ICT的低反应性(<30%)。为了消耗CD8+细胞毒性T细胞,肿瘤细胞不仅在细胞表面表达PD-L1,还通过多泡体与质膜的融合分泌外泌体PD-L1。血液中的外泌体PD-L1通过降低CD8+细胞毒性T细胞生物活性来抑制抗PD-1抗体(αPD-1)的效果。事实上,Rab27a或nsMase敲除肿瘤细胞中PD-L1(+)EXO的减少以免疫依赖性方式抑制了肿瘤生长。为了克服肿瘤EXO诱导的ICT限制,有必要设计并控制肿瘤细胞EXO分泌的策略。在之前的一项研究中,研究团队曾报道了磺胺异恶唑(SFX)通过靶向内皮素受体A(ETA) 抑制EXO分泌来抑制肿瘤生长和转移。这一发现暗示SFX对肿瘤来源的EXO的抑制有可能会消除肿瘤来源的外泌体PD-L1带来的的免疫逃逸。因此,研究人员认为,阻止肿瘤细胞EXO生物发生的SFX可以转换免疫细胞的功能和活性来显著提高ICT的治疗反应。在这项研究中,研究人员发现在动物模型中,当与αPD-1联用时,SFX显著降低了血液中的外泌体PD-L1水平并激活了CD8+细胞毒性T细胞。研究结果表明,SFX通过抑制外泌体PD-L1来调节免疫抑制性肿瘤微环境(TME),因此可用作增敏αPD-1治疗反应性的潜在药物。参考文献:Sulfisoxazole Elicits Robust Antitumour Immune Response Along withImmune Checkpoint Therapy by Inhibiting Exosomal PD-L1. Adv Sci (Weinh). 2021Dec 20:e2103245.外泌体资讯网 AdvancedScience:磺胺异恶唑通过抑制外泌体PD-L1产生良好的抗肿瘤免疫治疗反应