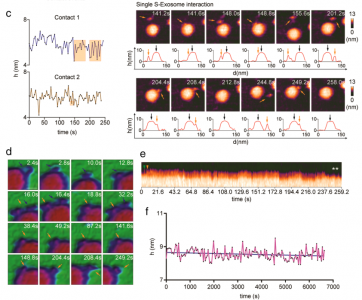
ARS-CoV-2刺突蛋白(S)与人血管紧张素转换酶2(hACE2)结合,使病毒能够停靠在细胞膜上,随后病毒进入。该研究使用高速原子力显微镜(HS-AFM)实时可视化S及其与hACE2和小细胞外囊泡(sEV)的相互作用。2019年冠状病毒病(COVID-19)是一种由新出现的β-冠状病毒(β-CoV)SARS-CoV-2引起的大流行病,给许多国家带来了毁灭性的社会经济影响。SARS-CoV-2是一种有包膜的、单链RNA病毒。与其他包膜病毒一样,SARS-CoV-2进入需要膜融合,这一过程由一组高度糖基化的同三聚体I类融合蛋白(称为刺突(S)蛋白)参与。S蛋白由球状头部S1亚基和茎状S2亚基组成。S1亚基介导宿主识别,而S2亚基负责膜融合。S1亚基具有四个域:N端域(NTD)、受体结合域(RBD)和两个结构保守的亚域(CTD1或SD1,以及CTD2或SD2)。七肽重复序列(HR1和HR2)和高度疏水的融合肽(膜融合的重要组成部分)位于S2亚基中。SARS-CoV-1和SARS-CoV-2的S蛋白与相同的受体血管紧张素转换酶2(ACE2)结合。与SARS-CoV-1 S蛋白的RBD相比,SARS-CoV-2 S蛋白的RBD对ACE2的结合亲和力更高。SARS-CoV-2 S蛋白有两个切割位点,S1/S2和S2'。S1/S2位点被宿主前蛋白转化酶furin蛋白酶切割,将S蛋白转化为亚稳态。受体结合后,宿主表面丝氨酸蛋白酶(跨膜丝氨酸蛋白酶2,TMPRSS2)或宿主内体半胱氨酸蛋白酶组织蛋白酶B和L(CatB/L)在S2'位点切割S蛋白以去除S1亚基。S1亚基解离暴露S2亚基并触发其重排以完成膜融合。了解S蛋白的蛋白质构象和动态行为对于阻止SARS-CoV-2进入并加快合成疫苗和靶向药物的开发至关重要。几个小组报告说,S蛋白构象是异质的,因为蛋白质根据RBD的位置以两种不同的形式存在:受体不可接近的形式(闭合构象;所有RBD向下)和受体可接近的形式(开放构象;至少一个RBD向上)。从封闭构象到开放构象的转变取决于S1亚基中的域间相互作用,其中相互作用可能受到弗林蛋白酶裂解、pH、温度和受体(ACE2)结合等外部因素的干扰。动态域间相互作用赋予S蛋白的构象可塑性,SARS-CoV-2在保留S蛋白融合能力的同时逃避宿主免疫至关重要。除了RBD,S茎的构象动力学也已通过冷冻电子显微镜(cryo-EM)成像得到解决。研究揭示S茎可以在病毒表面弯曲和旋转。这种动态特性提高了受体的可及性,从而增强了S蛋白在宿主表面的附着。迄今为止,S蛋白的构象动力学主要通过冷冻电镜成像来剖析。尽管冷冻电镜是结构分析的强大工具,但许多冷冻电镜图像是相当静态的快照。此外,用于冷冻电镜成像的SARS-CoV-2病毒必须用4%的多聚甲醛固定,因此可能无法完全概括S蛋白的构象动力学。单分子荧光(Förster)共振能量转移(smFRET)在捕获S蛋白的构象动力学方面具有很高的时间分辨率;然而,这种方法只能检测荧光信号。高速原子力显微镜(HS-AFM)可用于在纳米级范围内实时观察具有高时空分辨率的生物分子。该研究团队已经使用HS-AFM进行了生物分子成像,以进行结构表征、构象动力学观察,并揭示生物分子和细胞器的动态相互作用。最近,该团队使用HS-AFM来研究甲型流感融合蛋白血凝素的构象动力学。在这项研究中,研究人员使用HS-AFM观察了SARS-CoV-2 S胞外域在不同理化条件下的天然构象和构象动力学、ACE2结合以及与小细胞外囊泡(sEV)的相互作用。此外,还研究了S2亚基与sEV之间的相互作用。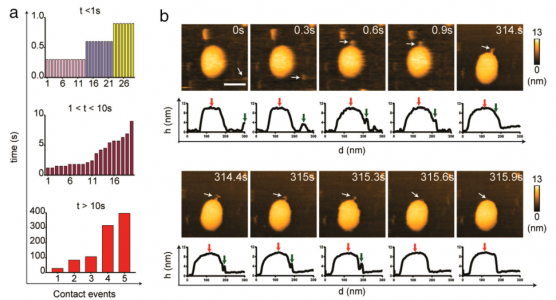
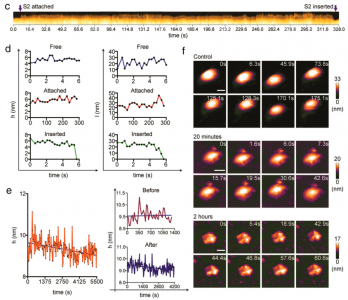
SARS-CoV-2Spike S亚基与sEV之间的实时相互作用结果显示S的构象异质性、S茎和受体结合结构域(RBD)的灵活性以及pH/温度诱导的S构象变化。S-ACE2复合物中的S表现为全RBD向上构象。该复合物在酸化后获得独特的拓扑结构。S和S2亚基在sEV上展示了不同的膜对接机制。S-hACE2相互作用促进S与sEV对接,这意味着表达ACE2的sEV用于病毒中和的可行性。相反,S2亚基停靠在脂质层上并使用其融合肽进入sEV,模拟病毒进入场景。总而言之,该研究提供了一个平台,适用于实时可视化各种进入抑制剂、中和抗体和基于sEV的诱饵以阻止病毒进入。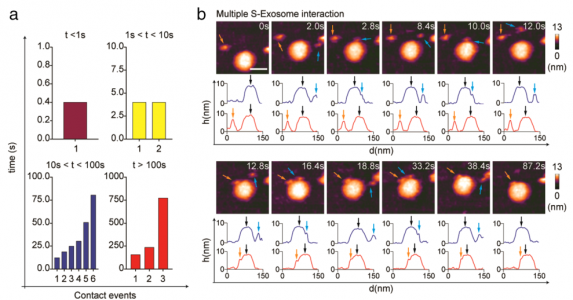
LimK, Nishide G, Yoshida T, Watanabe-Nakayama T, Kobayashi A, Hazawa M, HanayamaR, Ando T, Wong RW. Millisecond dynamic of SARS-CoV-2 spike and its interactionwith ACE2 receptor and small extracellular vesicles. J Extracell Vesicles. 2021Dec;10(14):e12170. doi: 10.1002/jev2.12170. PMID: 34874124.外泌体资讯网 JEV:新冠病毒刺突蛋白与ACE2受体和小细胞外囊泡的实时相互作用


