COVID-19大流行是对人类生活的重大挑战。SARS-CoV-2是病原体,可以通过气溶胶和呼吸道飞沫传播——呼吸道传播是主要模式——赋予病毒广泛的传播能力。COVID-19仍然对人类福祉构成威胁以及不可否认的医疗保健负担。
在SARS-CoV-2进入人体细胞之前对其进行中和是降低因病毒渗入肺部而导致的死亡率的合理目标选择。众所周知,疫苗诱导的免疫力在预防COVID-19传播中起着至关重要的作用。不幸的是,许多新出现的变体可以逃避免疫力;因此,需要采用阻止病毒细胞进入的新疗法作为补充解决方案。
SARS-CoV-2被证明使用血管紧张素转换酶2(ACE2)作为受体进入细胞。细胞表面ACE2的结合是病毒内吞作用的先导阶段;因此,阻断ACE2的受体结合域(RBD)的蛋白质-蛋白质相互作用(PPI)是临床预防SARS-CoV-2的重要方法。
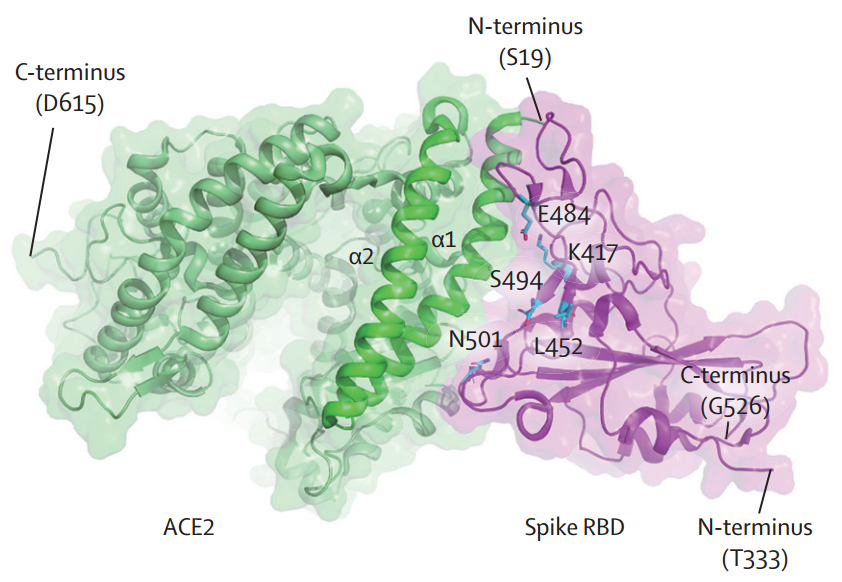 ACE2(绿色)和SARS-CoV-2刺突RBD(紫色)复合物的结构
ACE2(绿色)和SARS-CoV-2刺突RBD(紫色)复合物的结构
使用ACE2衍生物作为病毒拮抗剂是一种实用的策略,因为SARS-CoV-2在进化过程中倾向于保留ACE2结合能力。临床级人类重组可溶性ACE2(hrsACE2)可抑制Vero细胞、工程人体血管和肾脏类器官中的SARS-CoV-2感染。人们开发了其他可溶性ACE2衍生物以提高对刺突蛋白的亲和力和亲和力以及药代动力学。因此,ACE2衍生物在SARS-CoV-2抑制剂开发中占有一席之地。
随着许多SARS-CoV-2相关变体(VOC)的传播,人们发现了导致免疫逃避的关键突变,给COVID-19治疗带来了新的挑战。研究人员重新关注RBD–ACE2 PPI在突变时如何变化;重新审视SARS-CoV-2的进化轨迹证实了ACE2结合是一种可进化的特征。研究表明,循环VOC的特征是ACE2结合增强。这些发现阐明了重组ACE2及其模拟物作为久经考验的抑制剂的潜力。
这篇综述讨论了过去3年在ACE2衍生抑制剂设计策略和示例方面的进展,包括临床级重组ACE2、载有ACE2的细胞外囊泡、基于ACE2的中和抗体、ACE2肽和微型蛋白模拟物。增强功效的修饰可以进一步提高ACE2衍生物的结合亲和力,表明它们作为潜在治疗方法的贡献。此外,由于ACE2是SARS-CoV-2和其他一些冠状病毒之间的共享受体蛋白,因此对ACE2衍生物的全面说明和对未来ACE2模拟药物的探索很可能有利于针对新兴冠状病毒的广谱药物开发。
载有ACE2的细胞外囊泡
尽管sACE2显示出出色的抗病毒活性,但它的缺点是疗效持续时间短,消除半衰期约为10小时。在一项为期28天的多中心临床2期试验和临床病例报告中,hrsACE2被给予每天两次静脉注射以维持有效的药物浓度。因此,为了延长ACE2的持续时间,囊泡——一种流行的生物转移工具——已被许多研究人员用于ACE2保护。
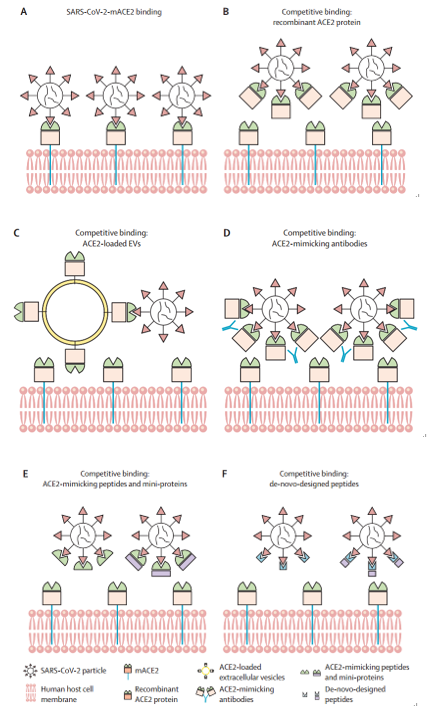
SARS-CoV-2与天然ACE2及其衍生物的结合模式示意图
细胞外囊泡是纳米级球形细胞分泌物,包裹生物活性大分子并保护它们不被消化酶降解,从而延长血液循环半衰期。在肺损伤动物模型中进行的基于细胞外囊泡的治疗抑制了炎症和肺纤维化在促进肺泡上皮和微血管生成的同时,表明基于细胞外囊泡的治疗具有相当大的对抗COVID-19的潜力,因为肺是SARS-CoV-2.54的主要感染器官。作为所谓的“陷阱宿主”抵抗SARS-CoV-2的感染和传播。
El-Shennawy及其同事发现,在COVID-19患者的血浆中,携带ACE2(evACE2)的内源性循环细胞外囊泡显著上调,分离的evACE2完全阻断了SARS-CoV-2感染引起的细胞死亡。此外,Zhang及其同事发现,这些含有ACE2的细胞外囊泡与刺突蛋白结合。含有ACE2和ACE2-TMPRSS2的细胞外囊泡也能抑制SARS-CoV-2假病毒的感染性,其功效比hrsACE2高约500-1500倍。此外,从工程化细胞系中分离出来的evACE2被证明在阻断病毒刺突蛋白方面比hrsACE2有效135倍,并且增强了对SARS-CoV-2参考毒株和alpha、beta和delta变种的广谱中和作用;这些结果得到了假病毒和活病毒检测的验证。后来表明,鼻内evACE2可以保护人类ACE2(hACE2)转基因小鼠免受SARS-CoV-2引起的肺损伤和死亡。同样,嵌入有工程化的ACE2(EVs-ACE2)在体外和体内均显示出对SARS-CoV-2假病毒的强大中和能力。EVs-ACE2给药在假病毒中和试验中将细胞荧光素酶活性降低了96%,并且在小鼠鼻上皮细胞中阻断S-假病毒的效率是未治疗对照组的100倍。
此外,sACE2及其突变体(即sACE2.v1[H34A、T92Q、Q325P和A386L]和sACE2.v2[T27Y、L79T、N330Y和A386L])先前已被证明可增强与SARS-CoV-2刺突蛋白与细胞外囊泡表面缺失跨膜区4(CD9ΔTM4)的截短形式的CD9结合,以生成工程化的细胞外囊泡。在细胞实验中,与sACE2(WT)-胞外囊泡相比,工程化的sACE2.v1-和sACE2.v2-胞外囊泡显示出对刺突蛋白的亲和力增加,并且对假病毒和真实病毒的中和作用更强。此外,工程化的sACE2.v1-细胞外囊泡还赋予K18-hACE2小鼠抗SARS-CoV-2感染的保护作用。29同时,ACE2的翻译后修饰也影响细胞外囊泡的作用。ACE2的Cys141和Cys498残基的棕榈酰化促进ACE2靶向细胞膜和细胞外囊泡的分泌。与EVs-ACE2相比,与S-棕榈酰化依赖性质膜靶向序列融合的工程EVs-ACE2在体外和hACE2转基因小鼠中对假型SARS-CoV-2和真实病毒具有更强的中和效力。
细胞外囊泡由于其固有的优势,例如出色的生物相容性、低免疫原性、纳米级尺寸和长血液循环半衰期,正成为开发药物递送载体和靶向药物递送的最理想的候选者之一。然而,细胞外囊泡发挥作用的机制和环境仍未完全了解,不同的生成来源、制备方法和其他因素导致的细胞外囊泡效力的异质性可能引发不可预见的副作用。因此,细胞外囊泡的生产和应用应受到严格监管,以确保EVs-ACE2可接受的安全性和有效性。
参考文献:
Zhang H, Lv P, Jiang J, Liu Y, Yan R, Shu S, Hu B, Xiao H, Cai K, Yuan S, Li Y. Advances in developing ACE2 derivatives against SARS-CoV-2. Lancet Microbe. 2023 Mar 16:S2666-5247(23)00011-3. doi: 10.1016/S2666-5247(23)00011-3. PMID: 36934742.




