免疫系统作为执行免疫应答及免疫功能的重要系统,与机体其他系统协调共同维持内环境稳态和生理平衡。当机体自身免疫耐受机制失调或被破坏而不可控制地激活后,会影响受累组织和器官的功能引发自身免疫性疾病。目前常用的免疫抑制类药物通常是非特异性的且具有多种副作用,因此迫切需要开发精准化的免疫耐受失调干预措施。
针对这一问题,来自苏州大学功能纳米与软物质研究院的汪超课题组开发了一种靶向病理组织并维持机体免疫耐受的基因工程化细胞外囊泡,相关成果以“Mesenchymal Stem Cell-derived Extracellular Vesicles with High PD-L1 Expression for Autoimmune Diseases Treatment”为题发表在Advanced Materials(2021, 6, e2106265)上。
为避免过度活跃的免疫应答导致自身免疫性疾病,人体进化出免疫检查点机制来控制免疫反应的强度和持续时间,最大限度地减少免疫应答对健康组织的损害。其中PD-1/PD-L1信号通路在抑制免疫应答的初始与效应阶段及维持机体的免疫自稳中扮演重要角色。近年来关于利用PD-L1高表达的生物载体治疗自身免疫性疾病的研究越来越多。
细胞外囊泡是一种直径为30-100 nm的细胞分泌的膜结构囊泡,可作为细胞间的信息交流物质介导细胞间通讯,由于其纳米尺寸,易到达病变部位。间充质干细胞来源细胞外囊泡与干细胞具有相似的生物学性能,如促进损伤组织的再生修复,具有较强的免疫功能调控作用等,并且易于在病理相关部位特异性靶向积累,在治疗系统性红斑狼疮、一型糖尿病、多发性硬化症等方面都展现出优越性。
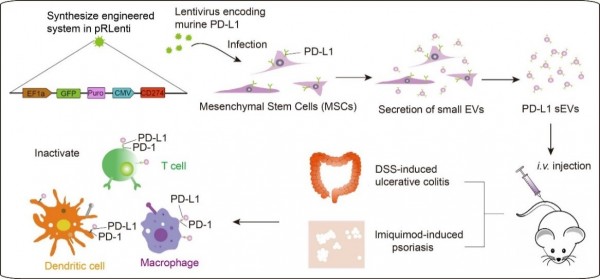
该研究利用慢病毒介导构建了高表达PD-L1的间充质干细胞起源的细胞外囊泡,通过与活化免疫细胞的PD-1相互作用启动免疫抑制信号,维持机体免疫耐受。 通过构建小鼠溃疡性结肠炎和银屑病模型,该研究发现此细胞外囊泡可以特异性靶向病变部位,通过调控免疫微环境重塑病变部位的正常生理功能。
图:高表达PD-L1的间充质干细胞外细胞囊泡对自身免疫性疾病的调控作用示意图
参考文献:Mesenchymal Stem Cell-derived Extracellular Vesicles with High PD-L1 Expression for Autoimmune Diseases Treatment. Adv Mater.2021, 6, e2106265
外泌体资讯网 Advanced Materials:工程化的间充质干细胞外细胞囊泡高表达PD-L1可用于自身免疫性疾病治疗