近些年,许多肿瘤病人在肿瘤免疫治疗中收益,肿瘤免疫治疗是目前临床肿瘤治疗中极具前景的治疗策略。但是,并不是所有的病人都会响应免疫治疗,这一方面归因于病人体内特异性识别肿瘤细胞的效应T细胞数量不足,另一方面归因于肿瘤免疫抑制微环境对免疫细胞的抑制作用。激活并扩增效应T细胞的同时改变肿瘤免疫抑制微环境是改变部分肿瘤病人免疫治疗响应不佳的必要策略。
针对这一问题,来自中国科学院中科院过程工程所生化工程国家重点实验室的马光辉/魏炜合作团队开发了一种淋巴结-肿瘤细胞双靶向的嵌合外泌体用于激活T细胞和改变肿瘤免疫抑制微环境,这一嵌合外泌体在论证试验中取得了很好的效果。相关成果以“Macrophage-tumorchimeric exosomes accumulate in lymph node and tumor to activate the immuneresponse and the tumor microenvironment”为题发表在近期出版的Science TranslationalMedicine上
肿瘤免疫疗法增强或利用身体免疫系统进行肿瘤免疫杀伤治疗是目前极具前景的肿瘤治疗策略。许多免疫疗法基于大量效应T细胞的产生,这些T细胞在体外被癌症特异性抗原特异性激活,然后过继转移到患者体内。还有各种所谓的癌症疫苗接种技术可以触发体内抗原特异性效应T细胞的产生。然而,简单地产生或转移大量癌症特异性T细胞通常不足以治疗实体瘤,因为肿瘤微环境(TME)中的免疫抑制条件会降低这些T细胞对实体肿瘤的渗透及其对肿瘤细胞的毒性功能。例如,肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Tregs)产生免疫抑制性细胞因子,如白细胞介素10(IL-10)和转化生长因子β(TGF-β),它们会影响效应T细胞的肿瘤内浸润能力、活力和功能。在这种情况下,可以同时增加癌症特异性T细胞产生和调节免疫抑制性肿瘤微环境的双靶向策略有望改善仅依靠T细胞产生的传统免疫疗法的治疗效果。
外泌体是由细胞分泌的天然纳米级(30至150nm)囊泡,这些囊泡含有生物分子成分,如蛋白质和脂质,它们反映了分泌它们的细胞类型。最近的研究表明,由巨噬细胞和其他抗原呈递细胞(APC)制备的外泌体可以有效地输送到次级淋巴器官,如淋巴结(LN)以进行免疫激活。由M1型巨噬细胞制备的外泌体具有将M2型巨噬细胞复极化为经典激活型的M1巨噬细胞的能力,这有利于改善免疫抑制性肿瘤微环境。受这些发现的启发,并鉴于其他研究表明癌细胞以及带有癌细胞成分的纳米疗法已被证明表现出肿瘤归巢行为,因此作者推测可以利用工程技术生产同时具有癌细胞和活化的巨噬细胞成分的嵌合外泌体,并整合上述独特功能以靶向和激活肿瘤微环境,增强肿瘤免疫治疗效果。
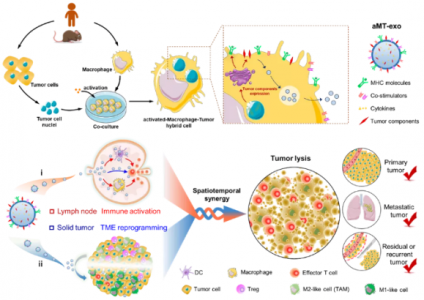
在本研究中,研究人员开发了巨噬细胞-肿瘤嵌合外泌体,这种嵌合外泌体可在淋巴结和实体瘤中积累,随后诱导时空免疫调节以抑制肿瘤。这种嵌合外泌体是从肿瘤细胞(包括E.G7小鼠淋巴瘤肿瘤细胞、4T1小鼠三阴性乳腺癌细胞、B16小鼠黑色素瘤细胞和MDA-MB-231人类三阴性乳腺癌细胞)中分离出的细胞核引入活化的M1巨噬细胞和然后制备出生物重编程的巨噬细胞-肿瘤嵌合外泌体,称为活化巨噬细胞-肿瘤细胞外泌体(aMT-exos)。研究人员完成了生物重编程嵌合APC-肿瘤细胞外泌体可用作增加T细胞产生和调节免疫抑制性肿瘤微环境的双效剂的概念证明。这一研究成果展示了如何使用从患者身上采集的肿瘤材料来制备个性化的双靶向作用免疫刺激纳米疗法,为增强肿瘤免疫治疗效果提供了的新策略。
图:嵌合型外泌体的制备及其用于双效协同肿瘤免疫治疗的机制示意图
参考文献;Macrophage-tumor chimeric exosomes accumulate in lymph node andtumor to activate the immune response and the tumor microenvironment