巨噬细胞的差异化激活与肿瘤进展密切相关,而KDM6B可能通过某种机制介导了这种巨噬细胞极化的调节。近日,来自南开大学医学院谭小月、米雪课题组的的研究人员发现,miR-138-5p通过外泌体从乳腺癌细胞传递到肿瘤相关巨噬细胞,下调了KDM6B 表达,促进巨噬细胞的M2 极化。因此外泌体miR-138-5p有希望作为乳腺癌预后标志物和治疗靶点。该研究发表于Theranostics杂志上。 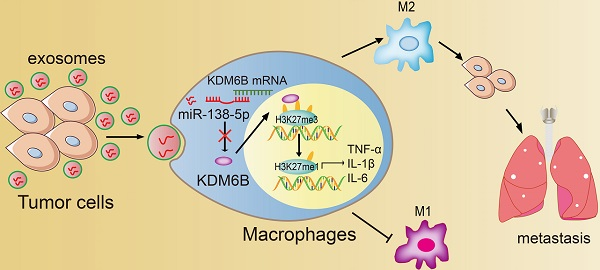
肿瘤相关巨噬细胞 (TAM) 是肿瘤微环境的重要组成部分,广泛参与调节肿瘤进展。巨噬细胞分为以下主要亚型:经典激活(M1)和可变激活(M2)。不同极化的巨噬细胞群与肿瘤命运相关,而M2 型巨噬细胞与肿瘤患者的不良预后相关。巨噬细胞的这种可塑性以及在肿瘤进展中的关键作用,表明重编程巨噬细胞的调节机制可作为癌症治疗的靶点。 转录因子活性、表观遗传修饰和代谢产物调节巨噬细胞的差异激活。例如,由组蛋白修饰酶介导的表观遗传重塑与 TAM 表型的调节有关。赖氨酸去甲基化酶3B(KDM3B,也称为JMJD1A)降低TAM的数量及其促血管生成活性。赖氨酸去甲基化酶6B(KDM6B,也称为JMJD3)的底物为H3K27me3/2,参与激活调节巨噬细胞活化所需的基因转录。此外,LPS、IL-4 或蠕虫感染会诱导KDM6B,从而调节巨噬细胞活化。然而,KDM6B表达的调控以及KDM6B对TAM极化影响的潜在机制仍不清楚。miRNA 是内源性小非编码 RNA,包含20-25个核苷酸,通过靶向目标mRNA的3'-非翻译区 (UTR) 作为基因表达的转录后抑制因子。越来越多的证据表明,在肿瘤进展过程中,miRNA 调节了巨噬细胞的差异激活。此外,miRNA通常参与细胞间通信。例如,肿瘤细胞分泌不同的 miRNA 进入邻近细胞或循环中,促进肿瘤进展。研究人员认为,源自肿瘤细胞的miRNA-138-5p影响巨噬细胞中关键表观遗传调节因子KDM6B的表达和活性,从而影响巨噬细胞极化。miRNA不稳定,需要特定的载体才能将它们运送到靶细胞。例如,外泌体是包裹着脂质双层膜(直径30-100 nm)的小囊泡,是细胞间通讯的重要途径。肿瘤来源的外泌体提供多种分子,如蛋白质、脂质和核酸,这些分子有助于改变肿瘤微环境和建立促转移生态位。此外,有证据表明,肿瘤来源的外泌体将 miRNA 传递给 TAM,导致代谢和炎症发生变化。研究人员认为,miR-138-5p向巨噬细胞的传递是由外泌体介导的,并提出外泌体miR-138-5p作为肿瘤进展的预后生物标志物。 在这项研究中,通过乳腺癌细胞和巨噬细胞的悬浮共培养系统,研究人员发现,与富含miR-138-5p的乳腺癌细胞共培养的巨噬细胞中的KDM6B 表达下调。进一步研究表明,miR-138-5p抑制 KDM6B 表达,并且肿瘤细胞衍生的外泌体将miR-138-5p传递给巨噬细胞,从而抑制 M1 表型,同时激活 M2 型极化。此外,外泌体miR-138-5p处理的巨噬细胞可促进转移性乳腺癌小鼠模型中的肺转移,并且外泌体miR-138-5p的循环水平与乳腺癌患者的癌症进展呈正相关。这些发现表明,外泌体miR-138-5p可能作为肿瘤进展的预后标志物以及治疗靶点。参考文献:Cancer-derived exosomal miR-138-5p modulates polarization of tumor-associated macrophages through inhibition of KDM6B. Theranostics. 2021 May 3;11(14):6847-6859.外泌体资讯网 南开大学医学院:乳腺癌细胞来源的外泌体miR-138-5p调节肿瘤相关巨噬细胞的极化





