去势抵抗性前列腺癌患者的治疗在临床上存在着挑战,急需开发新的靶标和疗法。近日,来自上海交通大学生物医学工程学院夏伟梁课题组与仁济医院沙建军课题组的研究人员开发了一种携带了SIRT6 siRNA的适体修饰的工程化外泌体,有希望成为前列腺癌的新型治疗工具。该研究发表于Theranostics杂志上。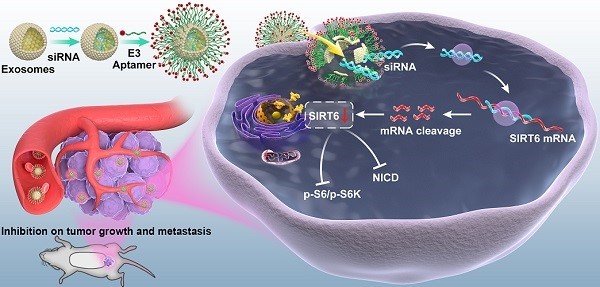
前列腺癌是全世界男性中最普遍的恶性肿瘤之一,每年约有130万新发病例。在我国,近五年来前列腺癌发病率呈上升趋势。大多数早期局限性前列腺癌可以通过前列腺切除或放疗治愈,但是转移性前列腺癌的治疗易受到耐药的阻碍。前列腺癌是由雄激素的驱动而引起的,以雄激素受体(AR)为靶点的雄激素剥夺疗法(ADT)是转移性前列腺癌治疗的主要手段。ADT在初期有效,但大多数患者不可避免地会在2-3年内发展成转移性去势抵抗性前列腺癌(mCRPC)。抗雄激素药,例如阿比特龙和恩杂鲁胺在降低AR信号传导活性方面非常有效,但疾病仍然会进展并且平均生存期仅为16-18个月。因此,进一步了解与前列腺癌进展相关的其他分子变化对于开发新靶点和疗法以延长CRPC患者的生存至关重要。Sirtuins属于高度保守的NAD+依赖性组蛋白去乙酰化酶家族,涉及多种细胞功能,例如衰老、代谢、应激反应和能量稳态。哺乳动物Sirtuins有七个家族成员(SIRT1-7),在细胞定位、催化活性和生物学功能上有所不同。SIRT6主要位于细胞核中,负责组蛋白H3第9位赖氨酸的乙酰化(H3K9Ac)和组蛋白H3 第56位赖氨酸乙酰化(H3K56Ac),调节基因转录。SIRT6还有两个附加的酶促功能,即去脂酰化和ADP-核糖基化。SIRT6与肿瘤的发展有典型的联系,最初被确定为肿瘤抑制因子。出乎意料的是,研究团队还发现SIRT6在前列腺癌的肿瘤组织高表达,并暗示了其在前列腺癌进展中的致癌作用。在其他类型的癌症中也已经证明了这种促进肿瘤的作用。然而,仍然缺乏关于SIRT6在前列腺癌中的致癌作用和通过调节SIRT6的潜在应用的详细研究。在精密纳米医学领域,工程化的外泌体是有前途的高效药物输送系统,它们在临床试验中的应用前景广阔。外泌体大小为50-150 nm,几乎所有细胞都分泌。由于其良好的安全性和较长的循环半衰期,外泌体引起了人们广泛的兴趣,因为它们可以作为转运系统来转运用于各种疗法的小干扰RNA(siRNA)或化学药物。此外,可以用所需的配体(如适体或抗体)修饰外泌体的表面,以将其引导至目标部位。适体是短的单链寡核苷酸或具有特定三维结构的肽,可模拟抗体的功能,易于化学合成和修饰。E3适体可以被前列腺癌细胞而非正常上皮细胞识别并内化。考虑到目前缺乏有效的SIRT6特异性抑制剂,在这项研究中,研究人员采用了载有siRNA的适体修饰的外泌体来敲低SIRT6。 研究人员采用免疫组织化学方法检测了SIRT6在前列腺癌组织芯片中的表达,并通过体外和体内实验阐明了SIRT6的功能和潜在机制。通过携带少量siRNA的适体修饰的外泌体沉默SIRT6,研究人员在异种移植小鼠模型中测试了其治疗效果。结果显示,SIRT6表达与前列腺癌的进展呈正相关。SIRT6的缺失在体外和体内均显著抑制了前列腺癌细胞系的增殖和转移。SIRT6驱动的前列腺癌显示与多种信号通路相关,特别是Notch通路的激活。通过工程化外泌体传递的siRNA使SIRT6沉默,从而抑制了肿瘤的生长和转移。因此,SIRT6是转移性前列腺癌的驱动程序和治疗靶标,工程化的外泌体对SIRT6的抑制作用可作为临床应用中有希望的治疗工具。
参考文献:Targeted inhibition of SIRT6 via engineered exosomes impairs tumorigenesis and metastasis in prostate cancer.Theranostics. 2021 Apr 26;11(13):6526-6541.
外泌体资讯网 上海交通大学:工程化外泌体靶向SIRT6从而抑制前列腺癌的发生和转移





