新生血管性视网膜病变,如早产儿视网膜病变(ROP)、增值性糖尿病视网膜病变(PDR)和湿性年龄相关性黄斑变性(wAMD)已成为世界范围内的早产儿、劳动成年人和老年人视力损伤或失明的主要原因。这些疾病的病理特征主要是视网膜内部区域、视网膜表面或者脉络膜区域内的异常血管生长,导致血管通透性增加、血-视网膜屏障(BRB)破坏、出血、视网膜细胞凋亡和视网膜脱离,最终导致视力损伤或失明。眼内血管内皮生长因子(VEGF)水平升高被认为是导致血管异常生长和BRB破坏的主要原因。目前新生血管性视网膜病变的治疗手段十分有限,最常用的治疗方法为激光光凝疗法、玻璃体内注射类固醇激素和抗血管内皮生长因子(VEGF)抗体,通过抑制新生血管达到缓解疾病进展的目的。为了解决抗VEGF药物在玻璃体腔内扩散性差以及半衰期短的问题,需多次进行注射才得以提高抗VEGF疗效。然而玻璃体腔反复注射增加了感染、健康视网膜发生神经变性和眼内炎等发生的风险,更重要的是有相当比例的患者对这些治疗无明显应答等。针对视网膜血管疾病中抗血管新生治疗存在的潜在问题,例如反复玻腔注射带来的副作用,天津医科大学颜华、王晓虹课题组的研究人员利用血管内皮细胞来源的外泌体作为抗血管新生短肽药物的载体,构建了一个靶向视网膜血管的抗血管新生作用的新型运送系统,可以高效运输抗血管生成短肽药物至视网膜血管,从而抑制血管新生、血管渗漏和视网膜炎症。该研究于发表于Theranostics杂志,题为“Exosome- mediated delivery of an anti-angiogenic peptide inhibitspathological retinal angiogenesis”(Dong et al.,2021)。
外泌体(Exosome)是一类来源于机体或细胞的直径为50-150nm的生物纳米级囊泡结构,可携带多种蛋白、RNA、脂类等分子,具有在细胞间传递信号等重要作用。近年来,由于其免疫原性低、生物相容度高、纳米大小以及携带丰富的生物活性分子等优势,外泌体在疾病诊疗领域受到广泛重视和应用。为了克服外泌体作为生物纳米运输载体,药物负载率低、靶向修饰难等问题,该研究利用了新型外泌体锚定肽CP05的功能化系统 (Gao et al., 2018),实现了外泌体与抗血管新生治疗短肽KV11 (Yi et al., 2009; Zhao et al., 2009)的高效连接,并借助了外泌体归巢的特性,利用血管内皮细胞来源的外泌体作为载体,从而构建了高效靶向血管内皮细胞的抗血管新生短肽递送系统。研究人员发现通过较玻璃体腔内注射更为安全的球后注射方式,可以有效的将抗血管新生短肽递送到视网膜血管内皮细胞,并具有很好的稳定性。疗效方面,研究人员利用多种视网膜血管新生和渗漏的动物模型,进行了详细的评价,发现该药物递送系统可以有效的抑制病理性血管新生过程中的内皮增殖、血管通透性的增加以及炎症浸润等,并具有很好的安全性,从而证实了该抗血管生成药物运输载体系统对新生血管性疾病的治疗作用。此外,该抗血管生成药物运输系统在体外培养的血管内皮细胞中也展示了较强的血管生成作用,体现在内皮细胞增殖、迁移和出芽能力的抑制。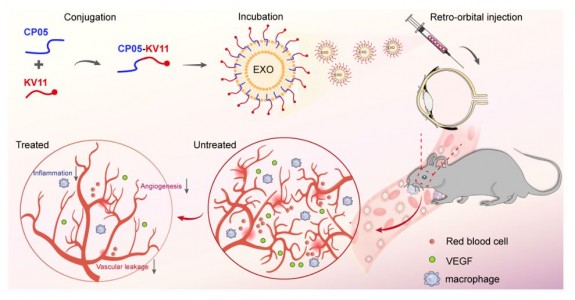
此外,在机制方面,尽管抗血管生成短肽KV11抑制血管生成的作用机制尚未研究透彻,但KV11具有已知的抑制VEGF下游信号通路细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)和Src激酶激活的作用。这两个蛋白激酶分别调节了内皮细胞的增殖、迁移、内皮连接和屏障功能。血管内皮细胞来源的外泌体介导了抗血管生成短肽KV11在内皮细胞中的高效摄入,显著增强了KV11对内皮细胞在响应VEGF刺激时发生的ERK和Src磷酸化的抑制作用。VEGF刺激可以导致血管内皮钙黏蛋白VE-cadherin在酪氨酸位点Y685发生磷酸化,从而介导血管间连接的破坏和渗漏的发生。利用此外泌体载体系统后也可以显著抑制Y685的磷酸化,从而保护血管完整性。本研究利用外泌体作为载体,结合血管生物学方法和眼科学临床需求,构建了高效的、靶向性好的视网膜药物递送手段,为视网膜疾病的治疗提出新的策略。Dong, X., Lei, Y., Yu, Z., Wang, T., Liu, Y., Han,G., Zhang, X., Li, Y., Song, Y., Xu, H., Du, M., Yin, H., Wang, X., and Yan, H.(2021). Exosome-mediated delivery of an anti-angiogenic peptide inhibitspathological retinal angiogenesis. Theranostics 11(11): 5107-5126.Gao, X., Ran, N., Dong, X., Zuo, B., Yang, R., Zhou, Q.,Moulton, H., Seow, Y., and Yin, H. (2018). Anchor peptide captures, targets,and loads exosomes of diverse origins for diagnostics and therapy. Sci TranslMed 10.Yi,Z., Cho, S., Zhao, H., Wu, Y., Luo, J., Li, D., Yi, T., Xu, X., Wu, Z., andLiu, M. (2009). A novel peptide from human apolipoprotein(a) inhibitsangiogenesis and tumor growth by targeting c-Src phosphorylation inVEGF-induced human umbilical endothelial cells. Int J Cancer 124, 843-852.Zhao,H., Jin, H., Li, Q., Gu, Q., Zheng, Z., Wu, H., Ye, S., Sun, X., Xu, X., Ho, P., et al. (2009). Inhibition ofpathologic retinal neovascularization by a small peptide derived from humanapolipoprotein(a). Invest Ophthalmol Vis Sci50, 5384-5395.外泌体资讯网 天津医科大学:外泌体介导的视网膜药物递送系统用于治疗视网膜血管新生






