天津医科大学总医院张建宁教授、兰州大学李敏教授与美国Bloodworks Research Institute Jin-fei Dong教授、贝勒医学院Miguel A. Cruz合作发现,构象依赖的活化VWF的阻断改善了小鼠颅脑外伤。
失控性出血占创伤性死亡的30%至50%,原因是血管损伤和继发性凝血病。创伤引起的凝血障碍是由大量失血(失血性休克)、体液复苏引起的血液稀释和体温过低、组织缺血引起的代谢性酸中毒、血小板功能异常和纤维蛋白溶解亢进引起的。但是,凝血障碍在单纯外伤性脑损伤(TBI)的患者中同样普遍,这些患者没有明显的失血,体液复苏少且很少发生体温过低或全身性代谢性酸中毒。这表明TBI诱发的凝血病(TBI-IC)在机制上不同于颅外伤和失血性休克引起的凝血病。TBI-IC通常表现为继发性颅骨内出血,但它是一种全身性疾病,因为它可以在患者的外周血中检测到;有一个关键问题,即如何通过全身性散布局部性脑损伤来改变止血系统,这并不是颅外伤和失血性休克患者直接受到影响。
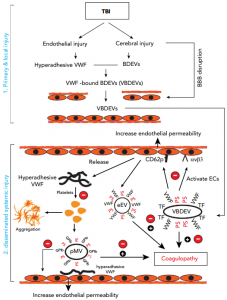
最近研究证明,遭受创伤的大脑释放表达衍生性促凝阴离子磷脂和组织因子的脑源性细胞外囊泡(BDEVs),诱导系统性高凝状态,该状态迅速转变为消耗性凝血病。粘性配体von Willebrand因子(VWF)可以介导细胞外囊泡(EV)诱导的内皮损伤并激活血小板以传播TBI-IC。对VWF进行了广泛的研究,发现其缺乏时会引起出血(例如von Willebrand病),而当其过度粘附时会引起微血管血栓形成(例如,血栓性血小板减少性紫癜)。然而,尽管VWF是与包括TBI在内的创伤预后不良相关的急性期反应物,但VWF在TBI-IC中的因果作用仍然知之甚少。
VWF通过将血小板束缚在暴露于血管损伤部位的内皮下层来止血。它在巨核细胞和内皮细胞(EC)中合成为单链原肽,形成各种分子量的多聚体。新合成的VWF多聚体要么组成型释放到循环中,要么存储在EC的WeibelPalade体以及巨核细胞和血小板的a颗粒中,并继续进行多聚化。从EC的存储颗粒分泌的VWF多聚体(eVWF)不仅很大,而且本质上是超粘的,能够自发地结合血小板和溶液中的其他细胞。相比之下,在循环血液血浆中发现的VWF多聚体(pVWF)结合血小板的能力很弱,除非它们固定在内皮下基质上或暴露于高流体剪切应力下。两种形式的VWF之间的关键结构差异是血小板结合的A1域隐藏在pVWF的球状结构中,但暴露在eVWF多聚体的表面上。
通过与相邻的A2结构域形成高亲和力复合物,可以将A1结构域隐藏在pVWF中。破坏该A1-A2复合物可通过暴露A1-结构域来激活pVWF。重组A2蛋白(A2)与血浆VWF多聚体的A1结构域结合并抑制了血流依赖性血小板粘附。这些观察结果使作者推测,急性TBI期间释放的VWF多聚体是固有激活的,因为A1结构域暴露并可以被A2选择性阻断以预防TBI-IC并改善TBI的预后。
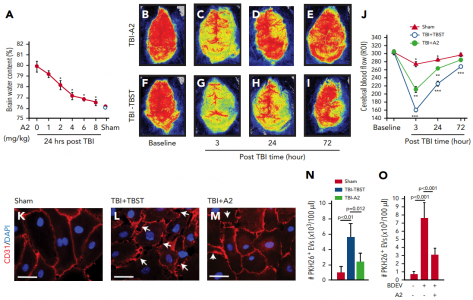
A2预防脑源性细胞外囊泡(BDEVs)诱发的血管渗漏
该研究证明,通过腹膜内注射或静脉内输注给予的A2可使TBI诱导的死亡减少> 50%,并显著改善遭受严重侧向液体打击的C57BL/6J雄性小鼠的神经功能。A2保护内皮免受细胞外小泡诱导的损伤,减少TBI诱导的血小板活化,并防止TBI诱导的高凝状态。A2通过特异性阻断急性TBI期间释放的高粘附性VWF上暴露的A1结构域来实现此治疗功效。这些结果表明,VWF在TBI-IC的发展中起着因果作用,并且是这种威胁TBI生命的并发症的治疗靶标。
模式图:VWF在TBI-IC中的作用及其被A2阻断
参考文献:
Xu, X., et al. (2021). "Conformation-dependent blockage of activated VWF improves outcomes of traumatic brain injury in mice." Blood 137(4): 544-555.
外泌体资讯网 Blood:基于构象的活化VWF阻断可改善小鼠脑外伤