免疫疗法已成为治疗胰腺导管腺癌(PDAC)的焦点,其中诱导肿瘤内效应免疫细胞以及逆转免疫抑制是PDAC治疗的核心。来自复旦大学药学院的蒋晨课题组的研究人员在Biomaterials杂志上发表文章,利用外泌体的双重递送siRNA和奥沙利铂,增强PDAC免疫原性并逆转M2肿瘤相关巨噬细胞的肿瘤免疫抑制,在PDAC治疗中取得显著的治疗效果。
胰腺导管腺癌(PDAC)是一种致命疾病,五年生存期低于6%。由于传统的治疗方法(如手术切除和化学疗法)收益有限,因此迫切需要PDAC的新疗法。近年来,免疫疗法被认为是癌症治疗的一种特殊策略,其特征在于活化的宿主免疫反应,伴随着肿瘤细胞的识别和消除。虽然免疫检查点抑制剂在白血病和黑色素瘤中取得了巨大成功,取得了巨大的发展,但令人遗憾的是,PDAC是一个例外,因为其独特的免疫抑制性肿瘤微环境(TME)和低免疫原性。
PDAC的TME具有极丰富的基质,几乎占据了肿瘤块的90%。免疫细胞在TME中并不罕见,并且包含接近50%的基质细胞成分,但是其中只有少数是抗肿瘤效应细胞。换句话说,大多数免疫细胞是被劫持的免疫抑制细胞,被迫促进肿瘤进展。这些抑制性免疫细胞,包括髓样来源的抑制细胞(MDSC)、M2极化的肿瘤相关巨噬细胞(M2-TAM)以及调节性T细胞(Treg),他们之间建立了全面的相互作用,抑制细胞毒性T淋巴细胞的功能。在最近的临床前研究中,在TAM和肿瘤细胞之间发现了一种新的机制,显示出促癌作用。Galectin-9(gal-9)是凝集素的β-半乳糖苷结合家族的成员,在小鼠和人类PDAC中都高度表达。 Galectin-9与dectin-1连接,可将巨噬细胞驱动为M2型。galectin-9的阻断导致反向的免疫抑制,增强CD4+和CD8+ T细胞效应激活以及减少肿瘤生长。这表明gal-9作为PDAC免疫疗法中新型治疗靶标的潜力。
然而,即使对PDAC进展中涉及的各种机制有了解,PDAC TME中的特殊病理生物学障碍,如高固相应力、血管不足、几乎不可穿透的基质,限制了治疗反应。用于药物输送的生物材料的最新进展已经使疾病的治疗取得了显着进展,包括PDAC,例如伊立替康脂质体,在临床试验中据报道可显着提高PDAC患者的中位总体存活率。这显示了基于生物材料的药物递送策略作为对抗肿瘤的新方法的潜力。尽管囊泡状脂质体有望克服严峻的障碍并显着增加肿瘤组织中的药物蓄积,但令人遗憾的是,许多这些合成的递送系统稳定性差,并且会引起严重的副作用。
因此,研究人员选择了研究外泌体,一种天然衍生物载体,作为药物递送平台,在PDAC治疗中具有独特的优势,如纳米尺寸、可生物降解的特征和肿瘤归巢功能。外泌体(直径40-150 nm)是具有脂双层结构的细胞来源的膜囊泡,可作为细胞间的沟通者,并能够针对肿瘤递送化学治疗药物、蛋白质或基因。值得注意的是,外泌体还显示出改善的稳定性,增强的内吞作用和降低的体内毒性。研究团队发现,源自骨髓间充质干细胞(BM-MSC)的外泌体在PDAC小鼠模型中显示出肿瘤归巢功能。这些证据表明,外泌体可以作为胰腺癌的的纳米级药物递送平台。
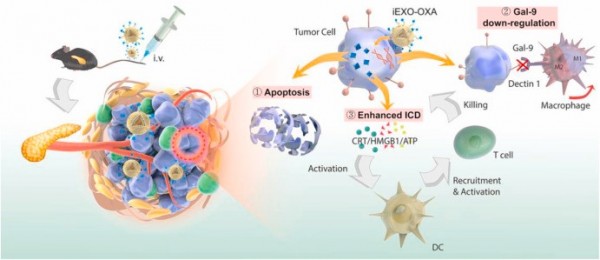
PDAC免疫治疗的另一个障碍是免疫原性低下,这意味着胰腺肿瘤患者的瘤内效应T细胞很少。由于免疫治疗的抗肿瘤效果很大程度上依赖于肿瘤细胞毒性T淋巴细胞的浸润,因此迫切需要在PDAC中增强免疫应答,招募更多的杀伤肿瘤的免疫细胞。最近的研究表明,诱导肿瘤细胞的免疫原性死亡(ICD)是诱导抗肿瘤免疫原性以支持免疫治疗的一种很有前途的策略。临床前报告表明,一些化疗药物能够诱导ICD反应。这些药物处理后,凋亡肿瘤细胞表面表达钙网蛋白(CRT),随后释放HMGB1并分泌ATP。CRT作为“吃我”信号,诱导树突状细胞(DC)吞噬死亡肿瘤细胞,HMGB1和ATP作为免疫刺激信号,启动树突状细胞成熟和抗原递呈,进一步激活抗肿瘤免疫应答,促进细胞毒性T淋巴细胞(CTL)在TME中的浸润。因此,化疗诱导的ICD可能是触发休眠的先天性或适应性免疫反应、杀死肿瘤细胞的一种有前途的策略。
受上述工作的启发,研究团队设计了一种以PDAC为靶点的外泌体生物平台,用于增强免疫治疗和重编程TME。奥沙利铂(OXA)是FOLF-IRINOX方案中用于PDAC治疗的一种成分,它既可以触发胰腺肿瘤部位的ICD效应,又可以通过抑制DNA合成和修复来杀死肿瘤细胞。为进一步提高抗肿瘤作用,研究人员利用gal-9siRNA阻断galectin-9/dectin-1,逆转M2-TAMs引起的免疫抑制。在联合治疗中,外泌体作为OXA和siRNA的载体,有利于提高药物的传递效率、肿瘤归巢和作用时间。制备siRNA EXO-OXA(iEXO-xa)纳米颗粒后,体外和体内实验表明,iEXO-OXA可优先传递到肿瘤部位,激发抗肿瘤免疫,增强血液循环时间,对PANC肿瘤有显著的治疗作用。
参考文献:Pancreatic cancer-targeting exosomes for enhancing immunotherapy and reprogramming tumor microenvironment.Biomaterials. 2020 Nov 23;268:120546.